Amino axit là một loại axit có vai trò quan trọng và thường được ứng dụng rất nhiều trong đời sống hàng ngày. Nếu bạn đang thắc mắc Amino axit là gì thì hãy cùng Gockhampha.edu.vn.COM.VN tổng hợp các kiến thức liên quan đến loại axit này nhé!
Bạn đang đọc: Amino axit là gì? Công thức, phân loại và vai trò của amino axit
Contents
Amino axit là gì?
Amino axit là một loại hợp chất hữu cơ tạp chức, có phân tử chứa cả nhóm amino (-NH2) và nhóm cacboxyl (-COOH) tương tác với nhau tạo thành một ion lưỡng cực. Công thức tổng quát của amino axit là:
R(NH2)x(COOH)y hoặc CnH2n+2-2k-x-y(NH2)x(COOH)y.
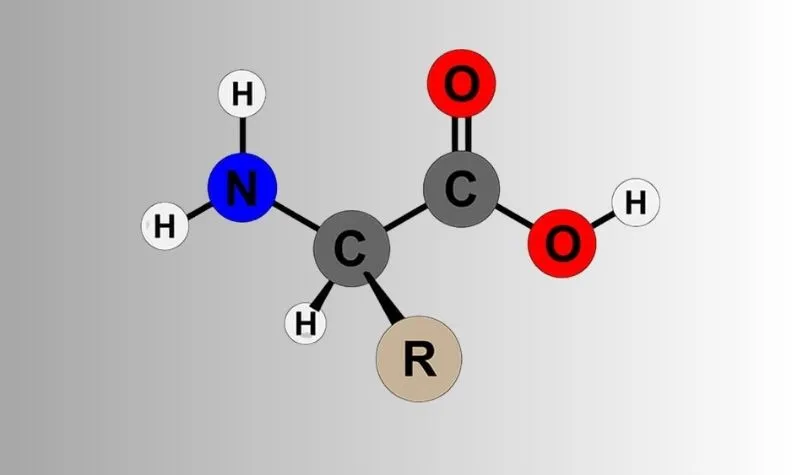
Công thức cấu tạo của Amino axit
Trong một phân tử amino acid, liên kết ion được tạo ra bởi liên kết giữa nhóm NH và nhóm COOH. Điều này dẫn đến sự tồn tại của dạng kết tinh của amino acid dưới dạng ion lưỡng cực.
Trong dung dịch, dạng lớn lưỡng cực của phân tử amino acid sẽ chuyển sang dạng phân tử thông qua phản ứng hóa học sau đây:
H2N-CH2-COOH (dạng phân tử) ⇌ H3N+-CH2+COO- (dạng lưỡng cực).
Trong phản ứng này:
- H3N+-CH2+COO- : đại diện cho dạng ion lưỡng cực của amino acid.
- H2N-CH2-COOH: đại diện cho các phân tử tách rời từ ion lưỡng cực.
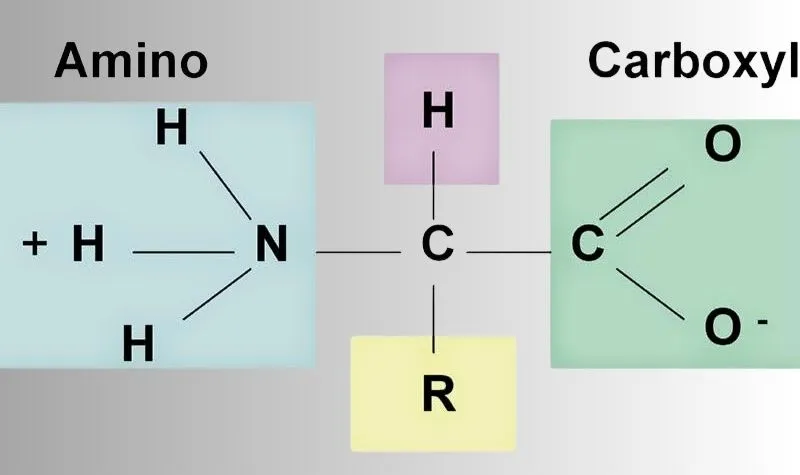
Các tên gọi của Amino axit
Tên thay thế
Cách đặt tên thay thế cho amino acid dựa trên cấu trúc như sau:
Tên acid + vị trí của nhóm amino + “amino” + tên acid cacboxylic tương ứng.
Ví dụ:
- H2N-CH2-COOH: Acid aminoethanoic
- HOOC-[CH2]2-CH(NH2)-COOH: Acid 2-aminopentanedioic
Tên bán hệ thống
Cách đặt tên thay thế cho amino acid theo hệ thống như sau:
Tên acid + vị trí của nhóm amino bằng chữ cái Hy Lạp + “amino” + tên thông thường của acid cacboxylic tương ứng.
Ví dụ:
- CH₃-CH(NH₂)-COOH: Acid alpha-aminopropionic
- H₂N-[CH₂]₅-COOH: Acid epsilon-aminocaproic
- H₂N-[CH₂]₆-COOH: Acid gamma-aminopentanoic
Tên thông thường
Các amino acid thiên nhiên hoặc a-amino acid được đặt tên theo tên thông thường. Dưới đây là một số ví dụ về amino acid tự nhiên và tên thông thường của chúng:
- NH₂-CH₂-COOH: Acid amino axetic, tên thông thường là glycine hoặc glycocol.
- CH₃-CH(NH₂)-COOH: Acid aminopropionic, tên thông thường là alanine.
- HOOC-CH₂-CH(NH₂)-COOH: Acid a-amino glutaric, tên thông thường là acid glutamic.
- (CH₃)₂CHCH(NH₂)COOH: Acid a-amino isovaleric, tên thông thường là valine.
- NH₂-(CH₂)₄-CH(NH₂)-COOH: Acid a,e-diaminocaproic, tên thông thường là lysine.
- HO-C6H4-CH₂-CH(NH₂)-COOH: Acid a-amino-ß hoặc p-hydroxyphenyl, tên thông thường là proline hoặc tyrosine.
Dưới đây là bảng tên thông thường của một số a-amino acid:
- Glycine (Gly)
- Alanine (Ala)
- Glutamic acid (Glu)
- Valine (Val)
- Lysine (Lys)
- Proline (Pro)
- Tyrosine (Tyr)
Phân loại các nhóm Amino axit
Tiêu chí phân loại các nhóm amino acid dựa trên cấu trúc gốc R có thể được chia thành năm nhóm như sau:
- Nhóm không phân cực, kị nước: Bao gồm Gly (G), Ala (A), Val (V), Leu (L), ILe (I), Pro (P).
- Nhóm gốc R nhân thơm: Bao gồm Phe (F), Tyr (Y), Trp (W).
- Nhóm gốc R bazơ, tích điện dương: Bao gồm Lys (K), Arg (R), His (H).
- Nhóm gốc R phân cực, không tích điện: Bao gồm Ser (S), Thr (T), Cys (C), Met (M), Asn (N), Gln (Q).
- Nhóm gốc R axit, tích điện âm: Bao gồm Asp (D), Glu (E).
Với các nhóm này, ta có thể phân loại hai mươi amino acid cơ bản thành từng nhóm tương ứng.
Tìm hiểu thêm: Điều chế khí oxi là gì? Phản ứng phân hủy là gì? – Hóa học 8 Bài 27
Tính chất vật lý
- Amino axit là chất rắn không màu và có vị hơi ngọt.
- Tính chất lưỡng cực của amino axit làm cho nó dễ tan trong nước.
- Nhiệt độ nóng chảy của amino axit cao, bởi vì nó là một hợp chất ion.
Tính chất hóa học
Làm đổi màu quỳ tím
Khả năng làm đổi màu của quỳ tím bởi amino axit phụ thuộc vào mối quan hệ giữa nhóm amino (R-NH2) và nhóm cacboxyl (COOH) trong công thức phân tử R(NH2)(COOH)y của amino axit.
- Khi x = y, amino axit không gây thay đổi màu sắc của quỳ tím.
- Trong trường hợp x
- Trong trường hợp x > y, amino axit có khả năng làm quỳ tím chuyển sang màu xanh.

Có tính lưỡng cực
Hợp chất có tính lưỡng tính là hợp chất có khả năng thể hiện tính acid và tính bazơ. Trong trường hợp của amino acid, nó có thể tác dụng với axit mạnh để tạo ra muối. Ví dụ về phản ứng này là:
NH2-CH2-COOH + HCl → ClNH3-CH2-COOH
Amino acid cũng có thể tác dụng với bazơ mạnh để tạo ra muối và nước. Ví dụ về phản ứng này là:
NH2-CH2-COOH + KOH → NH2-CH2-COOK + H2O
Phản ứng trùng ngưng
Quá trình tổng hợp polymer dựa trên phản ứng trùng ngưng giữa các monomer chứa nhóm chức tạo ra các liên kết mới trong mạch polymer và cùng tạo ra các sản phẩm phụ như nước hoặc axit HCL. Phản ứng trùng ngưng của amino acid có dạng tổng quát như sau:
nH2N-[CH2]-COOH → (-NH-[CH2]-CO-)n + nH2O
Khi trùng ngưng các amino acid như 6-aminohexanoic hoặc 7-aminoheptanoic với sự tham gia của chất xúc tác, ta thu được các polimer thuộc loại poliamit. Từ n amino acid khác nhau, ta có thể tạo ra n! polipeptit chứa n gốc amino acid khác nhau và n^n polipeptit chứa n gốc amino acid.
Tác dụng với HNO2
Phản ứng hóa học giữa amino acid và HNO2 có dạng tổng quát như sau:
HOOC-R-NH2 + HNO2 → HOOC-R-OH + N2 + H2O
Phản ứng este hóa
Phương trình phản ứng hóa học riêng của nhóm COOH hoặc phản ứng este hóa có dạng tổng quát như sau:
NH2-CH2-COOH + ROH → NH2-CH2-COOR + H2O.
Khả năng làm đổi màu của quỳ tím bởi amino axit phụ thuộc vào mối quan hệ giữa số nhóm COOH và số nhóm NH2 trong phân tử amino axit.
- Trong trường hợp số nhóm COOH bằng số nhóm NH2, quỳ tím sẽ không đổi màu.
- Trong trường hợp số nhóm COOH lớn hơn số nhóm NH2, quỳ tím sẽ chuyển sang màu đỏ.
- Trong trường hợp số nhóm COOH nhỏ hơn số nhóm NH2, quỳ tím sẽ chuyển sang màu xanh.
Dưới đây là một số ví dụ minh họa cho các phản ứng hóa học khi muối của amino axit tác dụng với dung dịch axit hoặc dung dịch kiềm:
NH2-CH2-COOK + 2HCI → NH3CI-CH2-COOH + KCI
NH3CI-CH2-COOH + 2KOH → NH2-CH2-COOK + KCI + H2O
Tương tự như acid cacboxylic, amino axit có thể phản ứng với ancol dưới sự xúc tác của acid vô cơ mạnh để tạo ra este. Dưới đây là một số ví dụ minh họa cho phản ứng hóa học này:
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O (xúc tác: H2SO4)
Khi este hình thành dưới dạng muối, phản ứng sẽ có dạng như sau: NH3CH2COOC2H5
Điều chế và ứng dụng
Điều chế
Amino axit có thể được điều chế thông qua quá trình thủy phân protein. Phản ứng hóa học tổng quát của quá trình thủy phân protein có dạng như sau:
(-NH-CH2-CO-)n + nH2O → nNH2-CH2-COOH
Ứng dụng
Trong thực tế, các amino axit thiên nhiên, đặc biệt là các amino axit amin chính, được sử dụng để tổng hợp protein. Protein là các phân tử sinh học quan trọng, được hình thành từ sự kết hợp của nhiều amino axit theo các liên kết phù hợp. Protein đảm nhiệm nhiều chức năng quan trọng trong tế bào và cơ thể, bao gồm:
- Glycine và glutamate có vai trò là chất dẫn truyền trong hệ thần kinh.
- Tryptophan là tiền chất để sản xuất serotonin, một chất truyền thần kinh quan trọng.
- Glycine tham gia vào quá trình tổng hợp porphyrins.
- Arginine có mặt trong quá trình tổng hợp hormone nitric oxide.
- Trong lĩnh vực công nghệ, phản ứng trùng ngưng của 6-aminohexanoic và 7-aminoheptanoic được sử dụng trong sản xuất sợi nilon-6 và nilon-7.

>>>>>Xem thêm: Tính chất hóa học và Tính chất vật lý của Oxi – Hóa học 8
Bài viết giúp bạn giải đáp thắc mắc: “Amino axit là gì?” và những kiến thức liên quan đến Amino axit. Chúc bạn có được những kiến thức hữu ích và hẹn gặp lại trong những bài viết tiếp theo của Gockhampha.edu.vn.COM.VN.

