Phản ứng cracking là gì? Cơ chế phản ứng cracking? Lý thuyết và bài tập phản ứng cracking?…Bài viết dưới đây của Gockhampha.edu.vn.COM.VN sẽ giúp bạn tìm hiểu chi tiết về chủ đề trên, cùng tìm hiểu nhé!.
Bạn đang đọc: Chuyên đề phản ứng cracking: Cơ chế, lý thuyết và Bài tập
Contents
Tìm hiểu phản ứng cracking là gì?
Định nghĩa phản ứng cracking
Trong điều kiện có nhiệt độ, áp suất cao và xúc tác thì ankan có thể bị bẻ gãy mạch C tạo thành các ankan và anken nhỏ hơn.
Cơ chế của phản ứng cracking
- Cracking được biết đến là quá trình trong đó các hợp chất hữu cơ phức tạp như kerogen hay các hydrocarbon cấu trúc lớn bị phá vỡ thành các hợp chất đơn giản hơn như các hydrocarbon nhẹ hơn, qua cách bẻ gãy các liên kết giữa các nguyên tử carbon trong các hợp chất trên.
- Tốc độ phản ứng của cracking cũng như các sản phẩm cuối cùng đều phụ thuộc rất nhiều vào nhiệt độ và sự có mặt của các chất xúc tác. Cracking làm phá vỡ các ankan lớn thành các anken nhỏ hơn và hữu dụng hơn. Quá trình này thường đòi hỏi nhiệt độ cao và áp suất cao.
Một số phản ứng cracking thường gặp
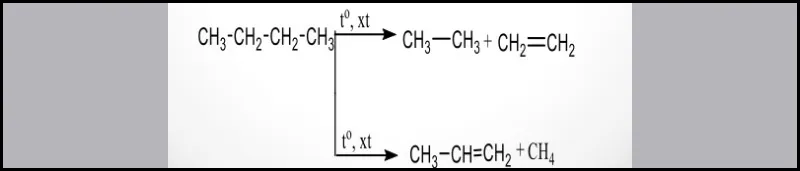
Phản ứng cracking butan C4H10
Khi thực hiện phản ứng cracking butan thì sẽ thu được hỗn hợp gồm các ankan và anken như:
C4H8,H2,CH4,C3H6,C2H6,C2H4,…
- Phương trình phản ứng:
C4H10→ C4H8+H2
C4H10→ CH4+C3H6
C4H10→ C2H6+C2H4
C4H10→ C3H8+CH2
Phản ứng cracking pentan C5H12
Khi thực hiện cracking butan thì sẽ thu được hỗn hợp gồm các ankan và anken như:
C5H10,H2,CH4,C3H6,C2H6,C2H4,…
- Phương trình phản ứng:
C5H12→ C4H10+CH2
C5H12→ C3H8+C2H4
C5H12→ C2H6+C3H6
C5H12→ CH4+C4H8
C5H12→ H2+C5H10
Các dạng bài tập về phản ứng cracking
Dạng 1: Cracking butan
Ví dụ 1: Crackinh butan thu được 35 mol hỗn hợp A gồm CH4,C2H6,H2,C2H4,C3H6,C4H8,C4H10 dư. Dẫn A lội qua bình nước brom dư thấy có 20 mol khí đi ra khỏi bình (biết rằng chỉ có C2H4,C3H6,C4H8 phản ứng với Br2 và đều theo tỉ lệ số mol 1:1). Nếu đốt cháy hoàn toàn A thì thu được a mol CO2.
- Tính hiệu suất phản ứng tạo hỗn hợp A.
- Tính giá trị của a.
Cách giải
1. Phương trình phản ứng:
C4H10→ t,xt∘CH4+C3H6
C4H10→ t,xt∘C2H6+C2H4
C4H10→ t,xt∘H2+C4H8
Số mol anken thu được:
nanken= 35–20= 15mol
Số mol butan ban đầu là:
nbd= nbutan= ns–nanken= 35–15= 20mol
Hiệu suất cracking butan là:
H = H=(ns−nbd)/nbd .100%
= H= [(35−20)/20].100% = 75%
2. Đốt cháy hỗn hợp A là đốt cháy butan:
Tìm hiểu thêm: Hidro sunfua là gì? Chuyên đề Hiđro sunfua và muối sunfua
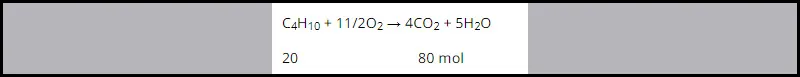
Vậy số mol CO2 thu được khi đốt cháy hỗn hợp A là 80 mol.
Dạng 2: Cracking pentan
Ví dụ 2: Cracking pentan một thời gian thu được 1,792 lít hỗn hợp X chỉ gồm các hiđrocacbon. Thêm 4,48 lít khí hiđro vào X rồi nung nóng với Ni đến phản ứng hoàn toàn thu được 5,824 lít khí hỗn hợp Y. Các thể tích đo ở điều kiện tiêu chuẩn. Đốt cháy hoàn toàn Y rồi cho sản phẩm cháy hấp thụ vào nước vôi trong dư. Khối lượng kết tủa tạo thành là bao nhiêu?
Cách giải:

>>>>>Xem thêm: Mol là gì? Định nghĩa khối lượng và công thức tính khối lượng mol
Dạng 3: Phản ứng cracking isopentan
Ví dụ 3: Thực hiện phản ứng cracking 11,2 lít hơi isopentan (đktc) thu được hỗn hợp A chỉ gồm các ankan và anken. Trong hỗn hợp A có chứa 7,2 gam một chất X mà khi đốt cháy thì thu được 11,2 lít khí cacbonic (đktc) và 10,8 gam nước. Hiệu suất của phản ứng này là bao nhiêu?
Cách giải:
Ta có:
nC5H12= 11,2/22,4= 0,5(mol)
Đốt cháy X được:
nCO2= 11,2/22,4= 0,5(mol)
nH2O= 10,8/18= 0,6(mol) >nCO2
Vậy X là ankan
nX= nH2O–nCO2= 0,6–0,5=0,1(mol)
Suy ra số C trong X là: 0,5/0,1= 5
Số H trong X là: (2.0,6)/0,1= 12
Vậy X là isopentan còn dư
Suy ra hiệu suất của phản ứng là:
H% = [(0,5−0,1)/0,5].100% = 80%
Dạng 4: Cracking hỗn hợp ankan
Ví dụ 4: Một hỗn hợp X gồm hai ankan A, B đồng đẳng kế tiếp. Crackinh 11,2 lít (đktc) hỗn hợp X thu được 22,4 lít hỗn hợp Y (đktc) gồm ankan, anken và H2, tỉ khối hơi của Y đối với H2 là 8,2. Vậy công thức phân tử và số mol của A, B lần lượt là bao nhiêu?
Cách giải:
Ta có:
MY/MX= nY/nX
MY= 8,2.2= 16,4
MY= 16,4.2= 32,8= 14ntb+2
MY= 16,4.2= 32,8= 14ntb+2
Vậy CTPT của A và B lần lượt là: C2H6,C3H8
nA/nB= 4/1= 0,4/0,1
Như vậy, bài viết trên đây của Gockhampha.edu.vn.Com.Vn đã giúp bạn tổng hợp kiến thức về chuyên đề phản ứng cracking. Chúc bạn luôn học tốt!.
Xem chi tiết qua video của thầy Phạm Thắng:

