Các dạng bài tập este là bài toán quen thuộc và quan trọng trong chương trình Trung học phổ thông. Để thực hiện được nhanh nhất và chính xác nhất, học sinh cần nắm được các dạng bài tập este và cách giải. Vậy cụ thể cần nắm vững kiến thức gì để giải các dạng bài tập este lipit? Trong nội dung bài viết dưới đây, Gockhampha.edu.vn.COM.VN sẽ giới thiệu đến bạn các dạng bài tập este cũng như phương pháp giải cụ thể, cùng tìm hiểu nhé!
Bạn đang đọc: Các dạng bài tập este trong đề thi đại học và phương pháp giải
Contents
Công thức tổng quát của este
Để giải được các dạng bài tập este, các bạn cần nắm vững kiến thức lý thuyết cũng như công thức tổng quát của este, cụ thể như sau:

Các dạng bài tập este trong đề thi đại học
Dạng 1: Dạng bài tập phản ứng đốt cháy este
Phương pháp giải
Phản ứng đốt cháy 1 este:
- Este no, đơn chức, mạch hở
- CTTQ: CnH2nO2,n≥2
- Phản ứng cháy:
- CnH2nO2+3n−22O2→nCO2+nH2O
- nCO2=nH2O
- nO2=32nCO2–neste
- Este không no, đơn chức, mạch hở có 1 liên kết C = C
- CTTQ: CnH2n−2O2,n≥4
- Phản ứng cháy:
- CnH2n−2O2+3n−32O2→nCO2+(n−1)H2O
- nCO2>nH2O
- neste=nCO2–nH2O
- Este không no, đơn chức, có k liên kết C=C trong phân tử
- CTTQ: CnH2n−2kO2
- Este không no, có từ 2 liên kết C=C trở lên trong phân tử
- CnH2n+2−2kOm+O2→nCO2+(n+1−k)H2O
- nCO2>nH2O
- neste=nCO2–nH2O/k−1
- Este bất kì
- CTTQ: CxHyOz. x, y, z nguyên dương, x≥2,z≥2
- Phản ứng cháy: CxHyOz+O2→xCO2+y/2H2O
- Áp dụng các định luật bảo toàn khối lượng, định luật bảo toàn nguyên tố… để giải bài toán.
Bài toán đốt cháy hỗn hợp các este
- Bài toán đốt cháy 2 este đồng phân
- Các este đồng phân ⇒ có cùng CTPT, cùng KLPT.
- Bài toán đốt cháy 2 este tạo thành từ cùng 1 axit, 2 ancol đồng đẳng hoặc cùng 1 ancol, 2 axit đồng đẳng
- Các este này sẽ có cùng dạng CTTQ ⇒. Đặt CTPT trung bình để viết phương trình phản ứng, đưa về bài toán 1 este.
- Số liên kết pi trong phân tử: k=(2nC–nH+2)/2
- Bài toán đốt cháy hỗn hợp nhiều este có cùng CTTQ
- Đặt CTPT trung bình
- Áp dụng các định luật bảo toàn để giải bài toán.
Ví dụ 1: Đốt cháy hoàn toàn 1,76 gam một este X thu được 3,52 gam CO2 và 1,44 gam H2O. Xác định công thức phân tử của X?
Cách giải
- Ta có:
- nCO2=3,5244=0,08(mol)
- nH2O=1,4418=0,08(mol)
- Do nCO2=nH2O⇒ X có độ bất bão hòa của phân tử Δ=1
- X là este no, đơn chức ⇒ X dạng CnH2nO2
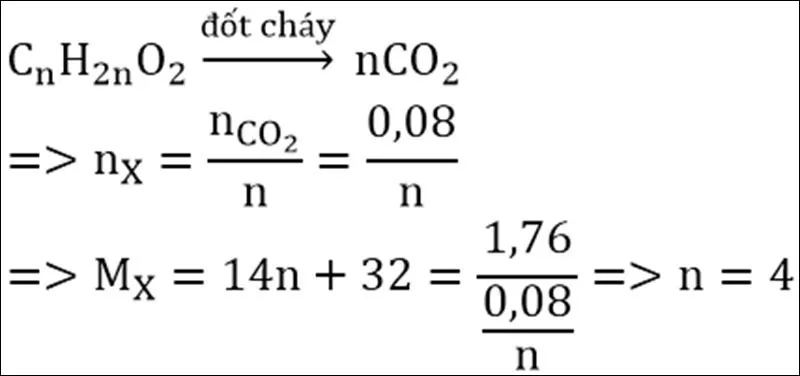
- Vậy công thức phân tử của X là: C4H8O2
Dạng 2: Bài toán về phản ứng thuỷ phân este
- Thuỷ phân một este đơn chức
- Trong môi trường axit: Phản ứng xảy ra thuận nghịch
- RCOOR′+HOH⇌RCOOH+R′OH
- Trong môi trường kiềm (phản ứng xà phòng hoá): Phản ứng một chiều, cần đun nóng
- RCOOR′+NaOH→t∘RCOOH+R′OH
- Thủy phân este đa chức
- Phương pháp giải
- Các dạng este đa chức
- Este tạo thành từ axit đơn chức và ancol đa chức (n chức): (RCOO)nR′
- (RCOO)nR′+nNaOH→nRCOONa+R′(OH)n
- Có thể là các axit khác nhau
- Este tạo thành từ axit đa chức (n chức) và ancol đơn chức: R(COOR′)n
- Este tạo thành từ axit đa chức (n chức) và ancol đa chức (m chức): Rm(COOR′)n.mR′n. Khi n = m thành R(COOR′)nR′→ este vòng
- Este no, 2 chức, mạch hở: CnH2n−2O4
- Trong phản ứng thủy phân este đa chức thì tỉ lệ: nNaOHNeste>1
- Nếu T = 2 ⇒ Este có 2 chức, T = 3 ⇒ Este có 3 chức…
Ví dụ 2: Muốn thuỷ phân 5,6 gam hỗn hợp etyl axetat và etyl fomiat (etyl fomat) cần 25,96 ml NaOH 10% (D = 1,08 g/ml). Thành phần % khối lượng của etyl axetat trong hỗn hợp là bao nhiêu ?
Cách giải
- Đặt x là số mol CH3COOC2H5 và y là số mol HCOOC2H5.
- Phương trình phản ứng:
- CH3COOC2H5+NaOH→CH3COONa+C2H5OH (1)
- HCOOC2H5+NaOH→HCOONa+C2H5OH (2)
- Theo giả thiết và các phản ứng ta có hệ phương trình :
- {88x+74y=5,6x+y=0,07⇔{x=0,03y=0,04
- ⇒ % mCH3COOC2H5 = 47,14 %.
Dạng 3: Dạng bài tập các phản ứng hóa học của este
Ví dụ 3: Hoàn thành sơ đồ phản ứng sau:
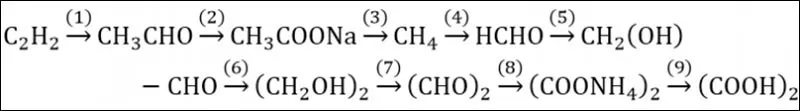
Cách giải
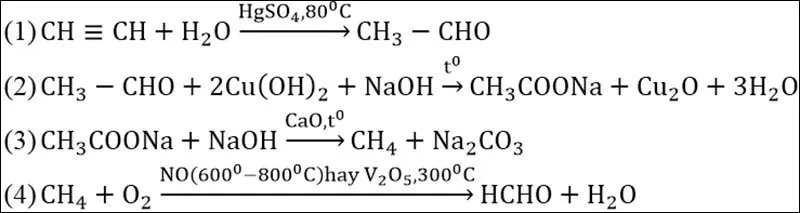
Tổng hợp kiến thức về bài tập este cơ bản
Tìm hiểu thêm: Đơn chất là gì, hợp chất là gì và phân tử là gì? Ví dụ cụ thể

Các dạng bài tập về este lipit trong đề thi đại học
Dạng 1: Phản ứng thủy phân lipit trong môi trường axit
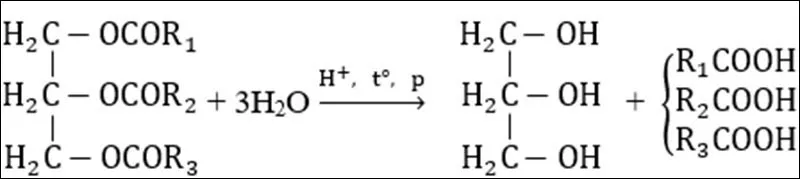
Trong công nghiệp, phản ứng trên được tiến hành trong nồi hấp ở 220∘C và 25 atm.
Dạng 2: Phản ứng xà phòng hóa của lipit
Khi đun nóng với dung dịch kiềm (NaOH hoặc KOH) thì tạo ra glixerol và hỗn hợp muối của các axit béo. Muối natri hoặc kali của các axit béo chính là xà phòng.
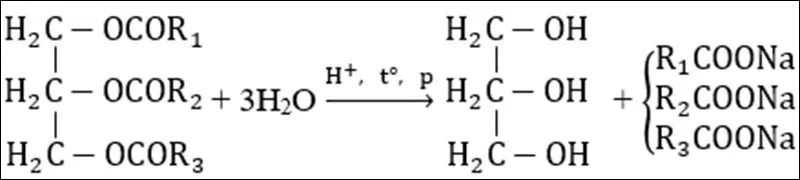
Phản ứng của chất béo với dung dịch kiềm được gọi là phản ứng xà phòng hóa. Phản ứng xà phòng hóa xảy ra nhanh hơn phản ứng thủy phân trong môi trường axit và không thuận nghịch.
Chỉ số xà phòng hóa: là số mg KOH dùng để xà phòng hóa hoàn toàn 1 gam lipit (tức là để trung hòa axit sinh ra từ sự thủy phân 1 gam lipit).
Chỉ số axit: số mg KOH dùng để trung hòa axit tự do có trong 1 mg lipit.
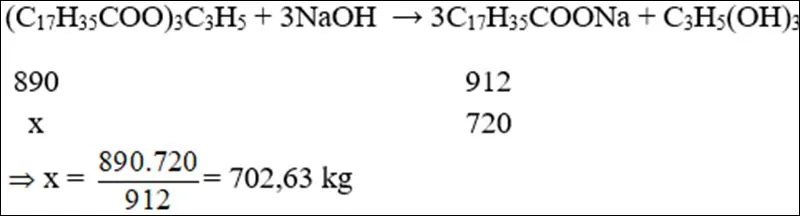
Ví dụ 4: Cần bao nhiêu kg chất béo chứa 89% khối lượng tristearin (còn 11% tạp chất trơ bị loại bỏ trong quá trình nấu xà phòng) để sản xuất được 1 tấn xà phòng chứa 72% khối lượng natri stearate.
Cách giải
Trong 1 tấn xà phòng có 72% khối lượng natri stearate.
>>>>>Xem thêm: Axit Clohidric là gì? Tính chất, Ứng dụng, Cách điều chế Axit
⇒mC17H35COONa=720kg
Khối lượng chất béo là : 702,63.10089=789,47kg
Trên đây là những tổng hợp của Gockhampha.edu.vn.VN về chủ đề các dạng bài tập este cùng phương pháp giải bài tập este khó. Hy vọng những kiến thức trong bài viết đã cung cấp đến bạn thông tin cần thiết về chủ đề các dạng bài tập este. Chúc bạn luôn học tốt!

