Cấu hình electron nguyên tử là một phần học thuộc chương trình Hóa học lớp 10. Đây là một phần căn bản nhưng vô cùng quan trọng để làm những bài tập Hóa học sau này. Hãy cùng theo dõi bài viết sau của Gockhampha.edu.vn.COM.VN về cấu hình electron nguyên tử để tìm hiểu thông tin nhé!
Bạn đang đọc: Cấu hình electron nguyên tử: Lý thuyết, cách viết và bài tập
Contents
- 1 Cấu hình electron nguyên tử biểu diễn điều gì?
- 2 Thứ tự các mức năng lượng trong nguyên tử
- 3 Cách viết cấu hình electron nguyên tử
- 4 Cách xác định nguyên tố s, p, d, f
- 5 Bảng cấu hình electron nguyên tử của 20 nguyên tố thường gặp
- 6 Đặc điểm cấu tạo của lớp electron ngoài cùng
- 7 Bài tập về cấu hình electron nguyên tử có lời giải
Cấu hình electron nguyên tử biểu diễn điều gì?
Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Cách viết cấu hình electron nguyên tử được quy ước như sau:
- Số thứ tự lớp electron được ghi bằng các chữ số 1, 2, 3,…
- Phân lớp được biểu diễn bằng các chữ cái thường như s, p, d, f
- Số electron trong một phân lớp được ghi bằng số phía trên bên phải của phân lớp ấy như s2, p6…
Ví dụ:
- Heli có cấu hình electron là 1s2.
- Kali có cấu hình electron là 1s2 2s2 2p6 3s2 3p6 4s1.
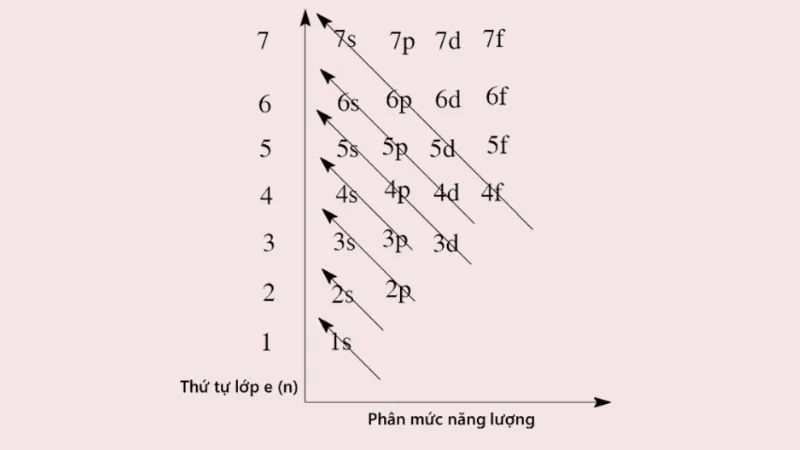
Thứ tự các mức năng lượng trong nguyên tử
Ở trạng thái cơ bản, các electron (e) nguyên tử lần lượt chiếm mức năng lượng từ thấp đến cao. Đồng thời, theo chiều từ trong ra ngoài thì mức năng lượng của các lớp tăng theo thứ tự từ 1 đến 7 và năng lượng của phân lớp tăng theo thứ tự là s, p, d, f.
Cụ thể, thứ tự sắp xếp các phân lớp theo chiều tăng của năng lượng được xác định như sau: 1s 2s 3s 3p 4s 3d 4p 5s… Khi điện tích hạt nhân tăng lên gây ra hiện tượng chèn mức năng lượng nên mức năng lượng 4s thấp hơn so với 3d.
Cách viết cấu hình electron nguyên tử
Các nguyên lý và quy tắc cần nhớ
Để viết được cấu hình electron nguyên tử cần nắm vững các nguyên lý và quy tắc sau:
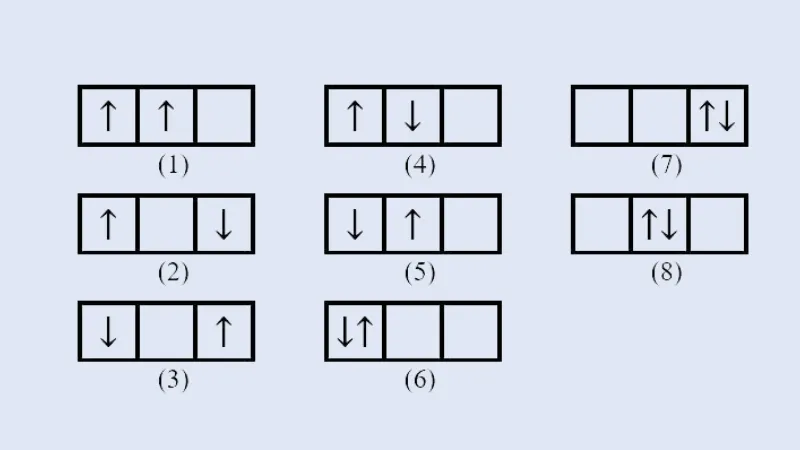
- Nguyên lý Pauli: Mỗi Obitan nguyên tử chỉ chứa tối đa hai electron. Hai electron này chuyển động tự quay ngược chiều nhau xung quanh trục riêng của mỗi electron.
- Quy tắc Hund: Trong cùng một phân lớp, các electron được phân bố sao cho số electron độc thân là tối đa trên các obitan và các electron này bắt buộc có chiều quay giống nhau.
- Nguyên lý vững bền: Ở trạng thái cơ bản, các electron sẽ phân bố lần lượt vào các obitan có mức năng lượng từ thấp đến cao.
Các bước viết cấu hình electron nguyên tử
Bước 1: Xác định đúng số electron của nguyên tử.
Bước 2: Các electron được phân bố lần lượt vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử như: 1s 2s 2p 3s 3p 4s 3d 4p,… và tuân thủ theo quy tắc sau:
- Phân lớp s chứa tối đa 2e.
- phân lớp p chứa tối đa 6e.
- Phân lớp d chứa tối đa 10e.
- Phân lớp f chứa tối đa 14e.
Bước 3: Viết cấu hình electron bằng cách phân bố electron trên các phân lớp thuộc các lớp khác nhau như: 1s 2s 2p 3s 3p 4s 3d 4p,…
Lưu ý:
- Sắp xếp cấu hình electron theo thứ tự từng lớp (1 → 7), trong mỗi lớp theo thứ tự từng phân lớp (s → p → d → f).
- Cần xác định chính xác số electron nguyên tử hay ion (số e (electron) = số p (proton) = Z (số đơn vị điện tích hạt nhân)).
- Nắm vững các quy tắc và nguyên lý, kí hiệu của lớp và phân lớp.
- Nắm vững quy tắc bán bão hòa hay bão hòa trên phân lớp d và f.
Tìm hiểu thêm: Indovinabank (IVB) là ngân hàng gì? Thông tin đầy đủ, chi tiết về Indovinabank

Cách xác định nguyên tố s, p, d, f
- Nguyên tố s: có electron cuối cùng được viết vào phân lớp s
- Nguyên tố p: có electron cuối cùng được viết vào phân lớp p
- Nguyên tố d: có electron cuối cùng được viết vào phân lớp d
- Nguyên tố f: có electron cuối cùng được viết vào phân lớp f
Lưu ý:
Trong một số trường hợp đặc biệt, các nguyên tố có cấu hình nguyên tử bán bão hòa:
- Cr (có Z = 24) 1s2 2s2 2p6 3s2 3p6 3d4 4s2 chuyển thành 1s2 2s2 2p6 3s2 3p6 3d5 4s1.
- Cu (có Z = 29) 1s2 2s2 2p6 3s2 3p6 3d9 4s2 chuyển thành 1s2 2s2 2p6 3s2 3p6 3d10 4s1.
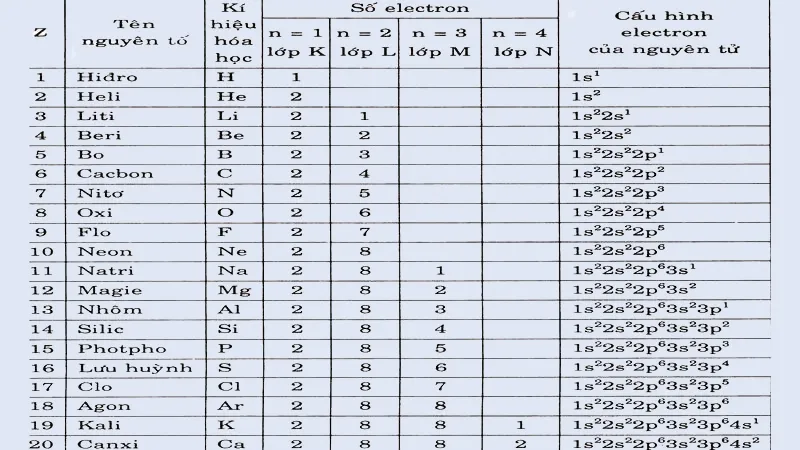
Bảng cấu hình electron nguyên tử của 20 nguyên tố thường gặp
Để có thể hiểu hơn về cấu hình electron nguyên tử, ta có bảng cấu hình electron nguyên tử của 20 nguyên tố thường gặp sau đây:
Đặc điểm cấu tạo của lớp electron ngoài cùng
Các electron ở lớp ngoài cùng quyết định tính chất hóa học của một nguyên tố. Đối với nguyên tử của tất cả các nguyên tố, lớp electron ngoài cùng có những đặc điểm chung sau đây:
- Có nhiều nhất là 8 electron.
- Các nguyên tử có 8e lớp ngoài cùng (ns2np6) và nguyên tử Heli (1s2) đều rất bền và hầu như không tham gia vào các phản ứng hóa học.
- Các nguyên tử có 1, 2, 3 e lớp ngoài cùng không tham gia vào các phản ứng hóa học (trừ 1 số điều kiện đặc biệt) vì cấu hình electron của các nguyên tử này rất bền. Đó là các nguyên tố khí hiếm chỉ có một nguyên tử.
- Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng dễ nhường electron là nguyên tử của các nguyên tố kim loại, ngoại trừ H, He và B.
- Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng dễ nhận electron thường là nguyên tử của nguyên tố phi kim.
- Các nguyên tử có 4 electron ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
Do vậy, lớp electron ngoài cùng quyết định tính chất hóa học của một nguyên tố. Khi biết cấu hình electron nguyên tử cũng có thể dự đoán được loại nguyên tố.
>>>>>Xem thêm: Thực phẩm là gì? Có mấy loại? Một số thực phẩm giàu dinh dưỡng
Bài tập về cấu hình electron nguyên tử có lời giải
Câu hỏi 1:
Nguyên tử nguyên tố Y có số khối là 16. Trong hạt nhân của Y, số hạt mang điện bằng số hạt không mang điện. Cấu hình electron của Y là
- 1s2 2s2 2p4
- 1s2 2s2 2p6 3s2 3p4
- 1s2 2s2 2p6
- 1s2 2s2 2p6 3s2 3p6
Đáp án: A
Phương trình giải:
- Số khối: A = Z + N
- Hạt nhân chứa p (mang điện) và n (không mang điện)
Lời giải chi tiết:
- Nguyên tử nguyên tố Y có số khối là 16 → Z + N = 16 (1)
- Trong hạt nhân của Y, số hạt mang điện bằng số hạt không mang điện → Z = N (2)
Giải (1) và (2) ⇒ Z = N = 8
→ Cấu hình e của Y: 1s2 2s2 2p4
Câu hỏi 2:
Tổng số hạt p, n, e trong nguyên tử nguyên tố A là 22. Vậy cấu hình electron của A là:
- 1s2 2s2 2p4
- 1s2 2s2 2p2
- 1s2 2s2 2p3
- 1s2 2s2 2p5
Đáp án: C
Lời giải chi tiết:
Tổng số hạt: p + n + e = 22 → 2p + n = 22
Ta có: p
⇒ p
⇒ 6,2
⇒ p = 7 = e
⇒ Cấu hình e: 1s2 2s2 2p3
Câu hỏi 3:
Cho số điện tích hạt nhân của nguyên tử là: X (Z = 6); Y (Z = 7); M (Z = 13); T (Z = 18); Q (Z = 19). Số nguyên tố có tính kim loại là:
- 3
- 4
- 2
- 1
Đáp án C
Lời giải chi tiết:
X (Z = 6): 1s2 2s2 2p2
Y (Z = 7): 1s2 2s2 2p3
M (Z = 13): 1s2 2s2 2p6 3s2 3p1
T (Z = 18): 1s2 2s2 2p6 3s2 3p6
Q (Z = 19): 1s2 2s2 2p6 3s2 3p6 4s1
Kim loại khi tổng số e lớp ngoài cùng
⇒ Chỉ có M và Q
Câu hỏi 4:
Nguyên tử của nguyên tố X có e cuối cùng điền vào phân lớp 3p1. Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3. Số proton của X,Y lần lượt là:
- 13 và 15
- 12 và 14
- 13 và 14
- 12 và 15
Đáp án A
Lời giải chi tiết:
X: 1s2 2s2 2p6 3s2 3p1: có 13 electron
Y: 1s2 2s2 2p6 3s2 3p3: có 15 electron
Câu hỏi 5:
Cho các nguyên tố có số hiệu nguyên tử lần lươt là Y (Z = 3); Z(Z – 7); E(Z = 12); T(Z = 18); R(Z = 19). Dãy gồm các nguyên tố kim loại là
- Y; T; R
- E; T; R
- Y; E; T
- Y; E; R
Đáp án D
Phương pháp giải:
Viết cấu hình e của các nguyên tử ra, các nguyên tử có số e lớp ngoài cùng là 1,2,3 e → đó là nguyên tố kim loại.
Lời giải chi tiết:
Y (Z = 3): 1s2 2s1 → có 1 e lớp ngoài cùng
Z(Z – 7): 1s2 2s2 2p3 → có 5 e lớp ngoài cùng
E(Z = 12): 1s2 2s2 2p6 3s2 → có 2 e lớp ngoài cùng
T(Z = 18): 1s2 2s2 2p6 3s2 3p6 → có 8 e lớp ngoài cùng
R(Z = 19): 1s2 2s2 2p6 3s2 3p6 4s1 → có 1 e lớp ngoài cùng
→ 3 nguyên tử Y, E, R có 1-3 electron lớp ngoài cùng nên là nguyên tố kim loại.
Trên đây là những kiến thức hữu ích về cấu hình electron nguyên tử. Hy vọng bài viết đã cung cấp cho bạn những thông tin cần thiết trong quá trình học tập. Hẹn gặp lại trong các bài viết tiếp theo của Gockhampha.edu.vn.COM.VN!

