Trong chương trình hóa học 10, chủ đề bảo toàn liên kết pi trong phản ứng cộng là phần kiến thức quan trọng giúp học sinh giải được nhiều bài toán khó. Vậy cụ thể bảo toàn liên kết pi là gì? Cách xác định số liên kết pi như nào? Các dạng bài tập bảo toàn liên kết pi thường gặp?… Hãy cùng Gockhampha.edu.vn.COM.VN tìm hiểu qua bài viết về liên kết pi dưới đây nhé!
Bạn đang đọc: Chuyên đề bảo toàn liên kết pi trong phản ứng cộng
Contents
Lý thuyết về bảo toàn liên kết pi
Bảo toàn liên kết pi là gì?
Tính chất cơ bản của hiđrocacbon không no là tham gia phản cộng nhằm phá vỡ liên kết pi.
Bảo toàn liên kết pi có thể hiểu đơn giản là việc bù lại phần H2 mất đi bằng H2 hoặc Br2 để ta có được hợp chất no (ankan).
Bản chất của bảo toàn liên kết pi
Khi ankan bị mất H2 nó sẽ biến thành các hợp chất không no và cứ mất đi một phân tử H2 thì hợp chất mới sẽ có liên kết pi là 1 (k =1).
Ví dụ:
Ankan mất đi 1 phân tử H2 biến thành anken có k = 1
Ankan mất đi 2 phân tử H2 biến thành ankin, ankadien,… có k = 2.
Dấu hiệu nhận biết bảo toàn liên kết pi
Dấu hiệu nhận biết bài toán sử dụng phương pháp bảo toàn liên kết pi như sau:
Bài toán hiđrocacbon không no cộng H2 sau đó cộng dung dịch Br2
→ Tính lượng Br2 đã phản ứng.
Cách xác định số liên kết pi
Số liên kết pi của hợp chất hữu cơ mạch hở A, công thức CxHy hoặc CxHyOz dựa vào mối liên quan giữa số mol CO2,H2O thu được khi đốt cháy A được tính theo công thức sau:
A là CxHy hoặc CxHyOz mạch hở, cháy cho nCO2–nH2O=k.nA thì A có số liên kết pi là: π=k+1
Lưu ý: Hợp chất CxHyOzNtClu có số liên kết πMax=2x–y–u+t+2/2
Phương pháp bảo toàn số mol liên kết pi
Cơ sở lý thuyết của phương pháp
Liên kết pi là liên kết kém bền vững, vì thế mà chúng dễ bị đứt ra để tạo thành liên kết σ với các nguyên tử khác. Khi có chất xúc tác như Ni, Pt hoặc Pd ở nhiệt độ thích hợp hiđrocacbon không no cộng hiđro vào liên kết pi.
Ta có sơ đồ sau:
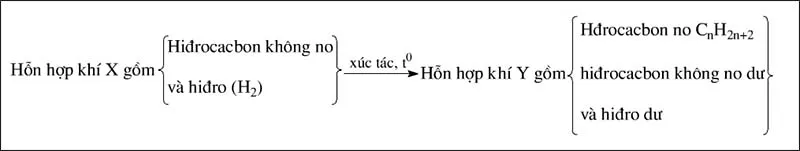
Phương trình hóa học của phản ứng tổng quát
CnH2n+2−2k+kH2→xt,t∘CnH2n+2 (1) (k là số liên kết pi trong phân tử)
Tùy vào hiệu suất của phản ứng mà hỗn hợp Y có hiđrocacbon không no dư hoặc cả hai còn dư.
Dựa vào phản ứng tổng quát (1) ta thấy,
Trong phản ứng cộng H2, số mol khí sau phản ứng luôn giảm (nY
nH2=nX–nY (2)
Mặt khác, theo quy định luật bảo toàn khối lượng thì khối lượng X bằng khối lượng hỗn hợp Y.
Ta có:
MY¯=mYnY; MX¯=mXnX
dX/Y=MX¯MY=mXnXmYnY=mXnX.nYmY=nYnX>1 ( do nX>nY)
Viết gọn lại ta có: dX/Y=MX¯MY=nYnX (3)
Hai hỗn hợp X và Y chứa cùng số mol C và H nên:
Khi đốt cháy hỗn hợp X hay hỗn hợp Y đều cho ta các kết quả sau:
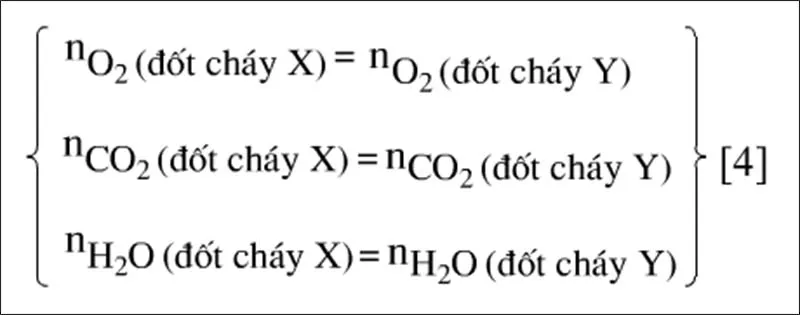
Do đó thay vì tính toán trên hỗn hợp Y (thường phức tạp hơn trên hỗn hợp X) ta có thể có dùng phản ứng đốt cháy hỗn hợp X để tính số mol các chất như: nO2pu,nCO2,NH2O
Số mol hiđrocacbon trong X sẽ bằng với số mol hiđrocacbon trong Y
nhidrocacbonX=nhidrocacbonY (5)
Trường hợp hiđrocacbon trong X là anken
Ta có sơ đồ sau:
Tìm hiểu thêm: Hidro sunfua là gì? Chuyên đề Hiđro sunfua và muối sunfua
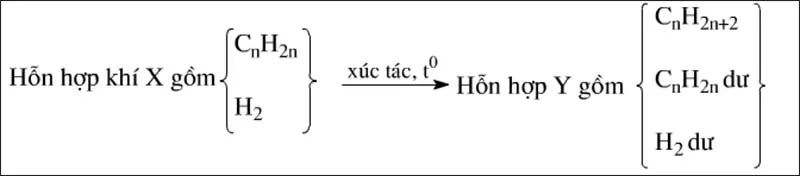
Phương trình hóa học của phản ứng:
CnH2n+H2→xt,t∘CnH2n+2
Đặt nCnH2n=a;nH2=b
Nếu phản ứng cộng H2 hoàn toàn thì:
Trường hợp 1: Hết anken, dư H2
nH2pu=nCnH2n=nCnH2n+2=amolnH2du=b–a}⇒nY=nCnH2n+2+nH2du=b
Vậy nH2(X)=nY (6)
Trường hợp 2: Hết H2, dư anken
nH2=nCnH2n+2=bmolnCnH2ndu=a–b}⇒nY=nCnH2n+2+nCnH2ndu=a
Vậy: nanken(X)=nY (7)
Trường hợp 3: Cả hai đều hết
nH2=nCnH2n=nCnH2n+2=a=b(mol)
⇒nY=nCnH2n+2=a=b
Vậy: nH2(X)=nanken(X)=nY (8)
Nếu như phản ứng cộng hidro không hoàn toàn thì sẽ còn lại cả hai.
Nhận xét:
Dù phản ứng xảy ra trong trường hợp nào thì ta luôn có:
nH2pu=nankenpu=nX–nY (9)
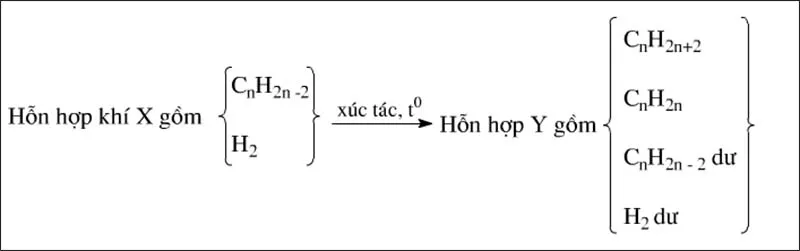
Trường hợp hiđrocacbon trong X là anken
Ankin cộng H2 thường tạo ra hai sản phẩm
CnH2n−2+2H2→xt,t∘CnH2n+2
CnH2n−2+H2→xt,t∘CnH2n
Nếu phản ứng không hoàn toàn, hỗn hợp thu được gồm 4 chất: anken, ankan, ankin dư và hiđro dư.
>>>>>Xem thêm: Mol là gì? Định nghĩa khối lượng và công thức tính khối lượng mol
Ta có sơ đồ:
Nhận xét:
nH2pu=nX–nY≠nankinpu
Bài tập bảo toàn liên kết pi
Bài 1: Cho H2 và 1 anken có thể tích bằng nhau qua niken nung nóng ta thu được hỗn hợp A . Biết tỉ khối hơi của A với H2 là 23,2. Hiệu suất phản ứng hiđro hóa là 75%. Tìm công thức phân tử của anken.
Cách giải
Trong cùng 1 điều kiện thì tỉ lệ thể tích cũng chính là tỉ lệ về số mol.
Theo giả thiết ta chọn: nH2=nCnH2n=1mol
CnH2n+H2→CnH2n+2
Theo phương trình, số mol khí giảm chính là số mol của H2
H% = 75% →nH2pu=0,75mol
→ Số mol khí sau phản ứng là:
nkhisaupu=nH2saupu+nCnH2nsaupu–nCnH2n+2=1+1–0,75=1,25mol
Áp dụng với định luật bảo toàn khối lượng ta có:
mA=mH2+mCnH2n=2+14n
→MA=mAnA→23.2,2=mA1,25→mA=58→2+14n=58→n=4
Vậy anken là C4H8
Bài 2: Dẫn 1,68 lít hỗn hợp khí X gồm 2 hidrocacbon vào bình đựng dung dịch brom (dư). Sau khi pư xảy ra hoàn toàn , có 4 gam brom đã pư và còn lại 1,12 lít khí. Nếu đốt cháy hoàn toàn 1,68 lít X thì sinh ra 2,8 lít khí CO2. CTPT của 2 hidrocacbon là gì? (biết các khí đều đo ở điều kiện tiêu chuẩn)
Cách giải
nX=1,6822,4=0,075mol
nBr2=0,025mol
Số mol khí còn lại là: 1,1222,4=0,05mol
→ số mol khí phản ứng với brom:
nX–nkhiconlai=0,075–0,05=0,025mol
→ số mol khí phản ứng với brom = nBr2=0,025mol
→ Khí phản ứng với Br2 là anken
→nanken=0,025mol
Khí còn lại là ankan, nankan=0,05mol
nCO2=2,822,4=0,125mol
→ Đốt cháy hoàn toàn 0,075mol X thì sinh ra 0,125 mol khí CO2
→ Số C trung bình của X là: 0,1250,075=1,67
→ Trong X phải chứa CH4→nCH4=0,05mol
Bảo toàn nguyên tố C: 0,05.1 + 0,025.n = 0,125 (n là số nguyên tử C trong anken)
→ n = 3 → anken đó là C3H6
Gockhampha.edu.vn.VN đã giúp bạn tổng hợp kiến thức về chuyên đề bảo toàn liên kết pi trong phản ứng cộng. Hy vọng thông tin trong bài viết có thể giúp ích cho bạn trong quá trình tìm hiểu chủ đề bảo toàn liên kết pi. Chúc bạn luôn học tốt!.

