Nhôm và hợp chất của nhôm là gì? Công thức hợp chất của nhôm? Các dạng bài tập điển hình về nhôm và hợp chất của nhôm… Hãy cùng Gockhampha.edu.vn.COM.VN tìm hiểu về chủ đề nhôm và hợp nhất của nhôm cũng như những nội dung liên quan qua bài viết dưới đây nhé!
Bạn đang đọc: Chuyên đề: Lý thuyết về Nhôm và Hợp chất của Nhôm
Contents
Nhôm là gì?
Trong chuyên đề về nhôm và hợp chất của nhôm, trước tiên chúng ta cần nắm được khái niệm nhôm là gì, vị trí của nhôm trong bảng tuần hoàn cũng như cấu hình electron nguyên tử của nhôm/.
Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử
- Cấu hình electron: (1s^{2}2s^{2}2p^{6}3s^{2}3p^{1})
- Al: thuộc nhóm IIIA, chu kỳ 3.
- Nhôm dễ nhường 3 e hoá trị, nên có số oxi hoá +3.
Tính chất vật lí của Nhôm là gì?
- Nhôm là kim loại nhẹ, màu trắng bạc, nóng chảy ở nhiệt độ không cao lắm.
- Nhôm rất dẻo, có thể dát được lá nhôm mỏng 0,01 mm dùng để gói thực phẩm.
- Có cấu tạo mạng lập phương tâm diện, có mật độ electron tự do tượng đối lớn. Do vậy nhôm có khả năng dẫn điện và nhiệt tốt.
Tính chất hóa học của Nhôm là gì?
Nhôm là kim loại có tính khử mạnh, nên nó bị oxi hoá dễ dàng thành ion nhôm (Al^{3+})
Ta có:
(Al rightarrow Al^{3+} + 3e)
- Tác dụng với Halogen
(2Al + 3Cl_{2} rightarrow 2AlCl_{3})
- Tác dụng với oxi
(4Al + 3O_{2} rightarrow 2Al_{2}O_{3})
- Tác dụng với axit
- Tác dụng với axit HCl:
(2Al + 6 HCl rightarrow 2AlCl_{3} + 3 H_{2})
- Tác dụng với axit (HNO_{3}, H_{2}SO_{4}) đặc, nóng:
(Al + 4HNO_{3} rightarrow Al(NO_{3})_{3} + 2H_{2}O + NO)
Chú ý: Nhôm bị thụ động trong (HNO_{3}, H_{2}SO_{4}) đặc nguội.
- Tác dụng với oxit kim loại
- Tác dụng với sắt (III) oxit:
(2Al + Fe_{2}O_{3} rightarrow Al_{2}O_{3} + 2Fe)
- Tác dụng với nước
- Vật bằng nhôm không tác dụng với nước ở bất kỳ nhiệt độ nào vì trên bề mặt nhôm được phủ bởi một lớp (Al_{2}O_{3}) rất bền. Nếu phá bỏ lớp bảo vệ này, thì nhôm tác dụng được với nước
- Phản ứng: (2 Al + 6H_{2}O rightarrow 2Al(OH)_{3} + 3H_{2})
- (Al(OH)_{3}) là chất rắn, không tan trong nước là lớp bảo vệ không cho nhôm tiếp xúc với nước nên phản ứng nhanh chóng bị dừng lại.
- Tác dụng với dung dịch kiềm
(Al_{2}O_{3} + 2 NaOH rightarrow 2NaAlO_{2} + H_{2}O)(1)
(2Al + 6H_{2}O rightarrow 2Al(OH)_{3} + 3H_{2}) (2)
(Al(OH)_{3} + NaOH rightarrow NaAlO_{2} + 2H_{2}O)(3)
Phản ứng (2), (3) xảy ra xen kẽ nhau mãi cho đến khi nhôm bị tan hết.
(2Al + 2NaOH + 2H_{2}O rightarrow NaAlO_{2} + 3 H_{2})

Ứng dụng và trạng thái tự nhiên của Nhôm
Ứng dụng của nhôm và hợp chất của nhôm là gì?
- Dùng chế tạo máy bay, ô tô, tên lửa …
- Trang trí nội thất, xây dựng nhà cửa.
- Dẫn điện, dẩn nhiệt tốt nên dùng làm dây cáp dẩn điện.
Trạng thái tự nhiên của nhôm
Nhôm là kim loại hoạt động mạnh nên trong tự nhiên chỉ tồn tại ở dạng hợp chất như: đất sét, mica, criolit …
Quy trình sản xuất Nhôm
- Nguyên liệu
Quặng boxit (Al_{2}O_{3}.2H_{2}O) quặng thường lẫn tạp chất là (Fe_{2}O_{3}) và (SiO_{2}), nên ta phải làm sạch nguyên liệu
- Nguyên tắc
Khử ion (Al^{3+}) thành Al.
- Phương pháp
Vì sự khử ion (Al^{3+}) trong (Al_{2}O_{3}) là rất khó khăn, không thể dùng các chất khử thông thường như (CO, C, H_{2}…) mà ta phải dùng phương pháp điện phân nóng chảy với xúc tác là criolit ((Na_{3}AlF_{6})) nhằm giảm nhiệt độ nóng chảy của (Al_{2}O_{3}) ((2050^{circ}C rightarrow 2900^{circ}C)) để tiết kiệm năng lượng, và tạo được chất lỏng có tính dẫn điện tốt hơn.
- Quá trình điện phân:
- Cực (-) : (Al^{3+} + 3erightarrow Al)
- Cực ( +) :Xảy ra sự oxi hoá (2O^{2-} rightarrow O_{2} + 4e)
Một số hợp chất quan trọng của nhôm
Nhôm oxit (Al_{2}O_{3})
Tính chất vật lí của Nhôm oxit (Al_{2}O_{3})
(Al_{2}O_{3}) là chất rắn, màu trắng, không tan trong nước và không tác dụng với nước, (t^{circ}nc=2050^{circ}C)
Tính chất hóa học của Nhôm oxit (Al_{2}O_{3})
- Tính bền: (Al_{2}O_{3}) khó bị khử bằng (C,H_{2},CO)
- Tính chất lưỡng tính:
(Al_{2}O_{3} + 6HCl rightarrow 2AlCl_{3} + 3H_{2}O)
(Al_{2}O_{3} + 2NaOH rightarrow 2NaAlO_{2} + H_{2}O)
Ứng dụng của Nhôm oxit (Al_{2}O_{3})
- Thường tồn tại dưới dạng ngậm nước và dạng khan:
- Dạng oxit ngậm nước là thành phần chủ yếu quặng boxit là nguyên liệu sản xuất nhôm.
- Dạng oxit khan có cấu tạo tinh thể giống đá quý: Tinh thể corindon trong suốt, không màu, rất rắn, chế tạo đá mài, giấy nhám…
- Bột nhôm oxit xúc tác cho tổng hợp hữu cơ.
Nhôm hidroxit (Al(OH)_{3})
Tính chất vật lí của Nhôm hidroxit (Al(OH)_{3})
- Là chất kết tủa keo, màu trắng
- Không tan trong nước, trong dung dịch (CO_{2},NH_{3}) nhưng tan được trong môi trường(H^{+},OH^{-}) mạnh.
Tính chất hóa học của Nhôm hidroxit (Al(OH)_{3})
- Tính chất kém bền nhiệt
(2Al(OH)_{3} overset{t^{circ}}{rightarrow} Al_{2}O_{3} + 3H_{2}O)
- Tính chất lưỡng tính
(Al(OH)_{3} + 3HCl rightarrow AlCl_{3} + 3H_{2}O)
(Al(OH)_{3} + NaOH rightarrow NaAlO_{2} + 2H_{2}O)
Nhôm Sunfat (Al_{2}(SO_{4})_{3})
- Muối nhôm sunfat khan tan trong nước (rightarrow) tỏa nhiệt do bị hiđrat hóa.
- Phèn chua: (K_{2}SO_{4}.Al_{2}(SO_{4})_{3}.24H_{2}O) hay viết gọn: (KAl(SO_{4})_{2}.12H_{2}O)
- Dùng trong ngành thuộc da, công nghiệp giấy, chất cầm màu trong ngành dệt vải, làm trong nước…
- (2AlCl_{3} + 3Na_{2}CO_{3} + 3H_{2}O rightarrow 2Al(OH)_{3} + 6NaCl + 3CO_{2})
Nhận biết ion (Al^{3+}) trong dung dịch
- Cho từ từ dd NaOH dư vào dung dịch, nếu thấy có kết tủa keo xuất hiện rồi tan trong dd NaOH thì chứng tỏ có ion (Al^{3+})
- (Al^{3+} + 3OH^{-}rightarrow Al(OH)_{3})
- (Al(OH)_{3} + OH^{-}rightarrow AlO^{2-} + 2H_{2}O)

Một số bài tập về nhôm và hợp chất của nhôm
Bài 1: Viết phương trình hóa học của các phản ứng thực hiện dãy chuyển đổi sau:
(Aloverset{(1)}{rightarrow} AlCl_{3} overset{(2)}{rightarrow} Al(OH)_{3}overset{(3)}{rightarrow} NaAlO_{2} overset{(4)}{rightarrow} Al(OH)_{3}overset{(5)}{rightarrow} Al_{2}O_{3}overset{(6)}{rightarrow}Al)
Cách giải:
((1), 2Al + 6HCl rightarrow 2AlCl_{3} + 3H_{2})
((2), AlCl_{3} + 3NaOH rightarrow Al(OH)_{3} + 3NaCl)
((3), Al(OH)_{3} + NaOH rightarrow NaAlO_{2} + 2H_{2}O)
((4) NaAlO_{2} + CO_{2} + 2H_{2}O rightarrow NaHCO_{3} + Al(OH)_{3})
((5) 2Al(OH)_{3}overset{t^{circ}}{rightarrow} Al_{2}O_{3})
((6), 2Al_{2}O_{3} overset{dpnc}{rightarrow} 4Al + 3O_{2})
Bài 2: Cho một lượng hỗn hợp Mg – Al tác dụng với dung dịch HCl dư thu được 8,96 lít (H_{2}). Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít (H_{2}). Các thể tích khí đều đo ở đktc.
Tính khối lượng của mỗi kim loại có trong lượng hỗn hợp đã dùng.
Cách giải:
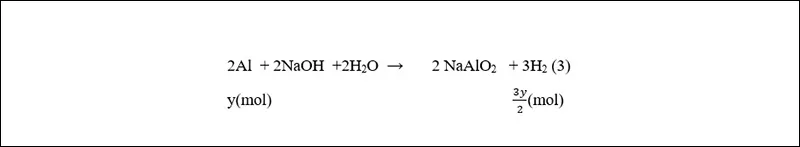
Gọi x, y (mol) lần lượt là số mol Mg, Al trong hỗn hợp.
Phương trình phản ứng:
Tìm hiểu thêm: Amoniac là chất gì? Cấu tạo phân tử, Điều chế và Ứng dụng của amoniac
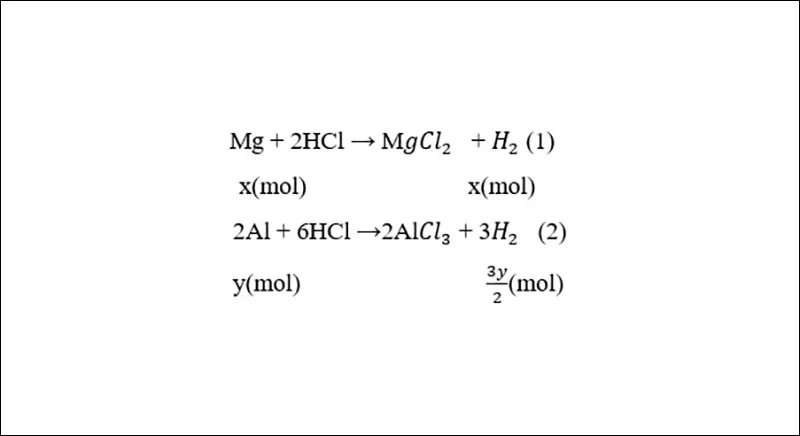
>>>>>Xem thêm: Sự điện li là gì? Cách phân loại và Bài tập về chất điện li
Số mol (H_{2})
(n_{H_{2}(1,2)} = frac{8,96}{22,4} = 0,4, (mol))
(n_{H_{2}(3)} = frac{6,72}{22,4} = 0,3, (mol))
Theo đề bài ta có hệ phương trình:
(left{begin{matrix} x+frac{3}{2}y = 0,4 frac{3}{2}y = 0,3 end{matrix}right. Leftrightarrow left{begin{matrix} x = 0,1 y = 0,2 end{matrix}right.)
Vậy:
Khối lượng Mg là 24.0,1 = 2,4 (g)
Khối lượng Al là: 27.0,2 = 5,4 (g)
Như vậy, nội dung trong bài viết đã giải đáp những thắc mắc nhôm và hợp chất của nhôm là gì, công thức hợp chất của nhôm cũng như các dạng bài tập điển hình về nhôm và hợp chất của nhôm. Hy vọng bạn đã tìm được kiến thức hữu ích cho mình trong quá trình học tập. Chúc bạn luôn học tốt!

