Điều chế khí oxi là gì? Có những cách nào để điều chế khí oxi? Phản ứng phân hủy, phản ứng nhiệt phân là gì? Một số dạng bài tập liên quan đến oxi và điều chế khí oxi? Cùng tìm hiểu qua bài viết sau của Gockhampha.edu.vn.COM.VN nhé!
Bạn đang đọc: Điều chế khí oxi là gì? Phản ứng phân hủy là gì? – Hóa học 8 Bài 27
Contents
Điều chế oxi trong phòng thí nghiệm
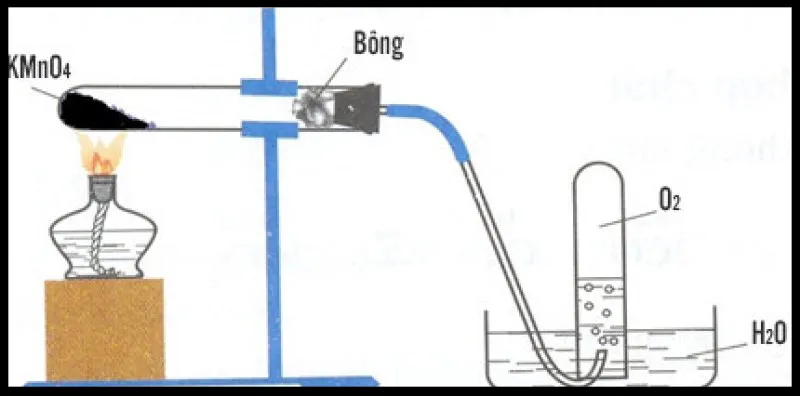
- Trong phòng thí nghiệm, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao như (KMnO_{4}) và (KClO_{3})
Phản ứng nhiệt phân kali pemanganat (KMnO_{4})
Khí oxi duy trì sự sống và sự cháy nên làm cho tàn đóm bùng cháy.
Phương trình hóa học:
(2KMnO_{4} overset{t^{circ}}{rightarrow} K_{2}MnO_{4} + O_{2})
Phản ứng nhiệt phân Kali clorat (KClO_{3})
(MnO_{2}) đóng vai trò là chất xúc tác.
Phương trình hóa học:
(2KClO_{3} overset{MnO_{2},t^{circ}}{rightarrow} 2KCl + 3O_{2})
Kết luận
- Trong phòng thí nghiệm, khí oxi được điều chế bằng cách đun nòóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao như (KMnO_{4}) và (KClO_{3})
- Có 2 cách thu khí oxi:
– Đẩy nước
– Đẩy không khí
- Một số lưu ý khi tiến hành thí nghiệm
– Khi làm thí nghiệm phải hơ nóng đều ống nghiệm trước khi tập trung đun đun ở đáy ống nghiệm để ống nghiệm nóng đều và không bị vỡ.
– Khi đun nóng (KMnO_{4}) ta phải đặt miếng bông ở đầu ống nghiệm để tránh thuốc tím theo ống dẫn khí thoát ra ngoài.
– Vì khí oxi nặng hơn không khí nên khi thu khí oxi bằng cách đẩy không khí phải đặt miệng bình hướng lên trên và đầu ống dẫn khí phải để ở sát đáy bình.
– Khi thu oxi bằng cách đẩy nước ta cần phải chú ý: rút ống dẫn khí ra khỏi chậu trước khi tắt đèn công.
Điều chế khí oxi trong công nghiệp
- Trong thiên nhiên nguồn nguyên liệu được dùng để sản xuất khí oxi là nước và không khí.
- Các nguyên liệu để điều chế khí oxi trong phòng thí nghiệm không thể dùng để sản xuất khí oxi trong công nghiệp được vì các nguyên liệu này hiếm và mắc tiền.
- Lượng oxi được điều chế trong phòng thí nghiệm ít, quy mô sản xuất nhỏ và rất đắt.
- Không thể dùng thiết bị để điều chế khí oxi trong phòng thí nghiệm để điều chế khí oxi trong công nghiệp vì những thiết bị đó quá quá phức tạp.
Sản xuất khí oxi từ không khí
Bằng cách hạ không khí xuống dưới (-200^{circ}C), sau đó nâng dần dần nhiệt độ lên (-183^{circ}C) ta thu được khí (N_{2}), hạ (-150^{circ}C) ta thu được khí oxi.
Sản xuất khí oxi từ nước
Người ta điện phân nước
(H_{2}O overset{dp}{rightarrow} H_{2} + O_{2})
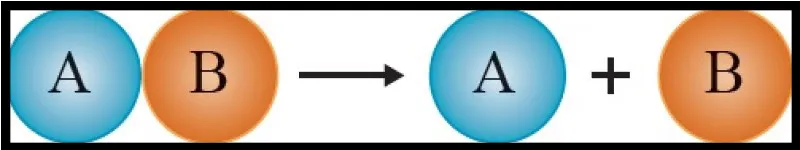
Phản ứng phân hủy
- Phản ứng phân hủy là phản ứng từ một chất ban đầu cho ra sản phẩm từ hai chất trở lên.
- Phản ứng hóa hợp và phản ứng phân hủy trái ngược nhau.
Tìm hiểu thêm: Khí CO2 là gì? Tính chất, nguồn gốc và ứng dụng Cacbon dioxit
>>>>>Xem thêm: Cacbohidrat là gì? Những vai trò của cacbohidrat đối với cơ thể
Một số dạng bài tập liên quan đến oxi và cách điều chế oxi
Ví dụ 1: Thể tích khí oxi sinh ra ở điều kiện tiêu chuẩn khi nhiệt phân 15,8 gam muối kali pemanganat là bao nhiêu?
Cách giải:
(n_{KMnO_{4}} = frac{15,8}{158} = 0,1, (mol))
Phương trình hóa học
(2KMnO_{4} overset{t^{circ}}{rightarrow} K_{2}MnO_{4} + MnO_{2} + O_{2})
Theo phương trình 2 mol kali pemanganat tạo ra 1 mol khí oxi
Vậy0,1 mol kali pemanganat tạo ra 0,05 mol khí oxi
Thể tích khí oxi sinh ra ở điều kiện tiêu chuẩn là:
(V_{O_{2}} = 0,05.22,4 = 1,12 , (l))
Ví dụ 2: Tính số mol và số gam kali clorat cần thiết để điều chế được:
- 48 gam khí oxi
- 44,8 lít khí oxi ở đktc
Cách giải:
- Ta có:
(n_{O_{2}} = frac{48}{32} = 1,5, (mol))
Phương trình hóa học:
(2KClO_{3} overset{t^{circ}}{rightarrow} 2KCl + 3O_{2})
Theo phương trình2 mol kali clorat tạo ra 3 mol khí oxi
Vậy (n_{KClO_{3}} = frac{2}{3}n_{O_{2}} = frac{2}{3}.1,5 = 1, (mol))
(Rightarrow m_{KClO_{3}} = n.M = 1.122,5 = 122,5, , (gam))
- Ta có:
(n_{O_{2}} = frac{44,8}{22,4} = 2, (mol))
Phương trình hóa học:
(2KClO_{3}overset{t^{circ}}{rightarrow} 2KCl + 3O_{2})
Theo phương trình, ta có:
(n_{KClO_{3}} = frac{2}{3}n_{O_{2}} = frac{2}{3}.2 = frac{4}{3})
Vậy (m_{KClO_{3}} = n.M = frac{4}{3}.122,5 = 163,3g)
Ví dụ 3: Trong phòng thí nghiệm người ta điều chế oxit sắt từ (Fe_{3}O_{4}) bằng cách dùng oxi hóa sắt ở nhiệt độ cao.
- Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?
- Tính số gam kali pemanganat (KMnO_{4}) cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol (KMnO_{4}) thì thu được 1 mol (O_{2})
Cách giải:
- Phương trình hóa học của phản ứng:
(3Fe + 2O_{2} rightarrow Fe_{3}O_{4})
(n_{Fe_{3}O_{4}} = frac{2,32}{232} = 0,01, (mol))
(n_{Fe} = 0,01 .3 = 0,03, (mol))
(n_{O_{2}}= 0,01 .2 = 0,02, (mol))
(m_{Fe}= 0,03 . 56 = 1,68, (mol))
(m_{O_{2}} = 0,02 . 32 = 0,64, (mol))
- Phương trình phản ứng nhiệt phân (KMnO_{4})
(2KMnO_{4} overset{t^{circ}}{rightarrow} K_{2}MnO_{4} + MnO_{2} + O_{2})
(n_{KMnO_{4}} = 0,02.2 = 0,04, (mol))
(m_{KMnO_{4}} = 0,04.158 = 6,32, (mol))
Gockhampha.edu.vn.COM.VN vừa cung cấp đến bạn những thông tin hữu ích về chủ đề điều chế khí oxi, những cách để điều chế khí oxi cũng như phản ứng phân hủy, nhiệt phân và một số dạng bài tập liên quan đến oxi. Hy vọng bạn đã tìm thấy những kiến thức bổ ích về chuyên đề điều chế khí oxi – phản ứng phân hủy. Chúc bạn luôn học tốt!