Hiđro là gì? Tính chất của hidro như nào? Những ứng dụng của hidro? Vì sao hidro có tính khử? Trình bày tính chất hóa học của hidro lớp 8?… Trong phạm vi bài viết sau, hãy cùng Gockhampha.edu.vn.COM.VN tìm hiểu về chủ đề tính chất của hidro cùng những nội dung liên quan nhé!
Bạn đang đọc: Hiđro là gì? Tính chất của hidro và Ứng dụng hidro
Contents
Tính chất vật lý của hidro
- KHHH : H
- Nguyên tử khối: 1
- Công thức phân tử: (H_{2}), phân tử khối: 2
- Khí hiđro là chất khí không màu, không mùi, không vị, nhẹ nhất trong các chất khí, tan rất ít trong nước.
- Hóa lỏng ở nhiệt độ (-183^{circ}C)
Tính chất hóa học của hidro
Tác dụng với oxi
- Đưa ngọn lửa hiđro đang cháy vào trong bình đựng khí oxi, hiđro tiếp tục cháy mạnh hơn, trên thàng lọ xuất hiện những giọt nước nhỏ (2H_{2} + O_{2} overset{t^{circ}}{rightarrow} 2H_{2}O)
- Hỗn hợp khí hiđro và khí oxi với tỉ lệ mol là 2:1 thì gây nổ mạnh.
Tác dụng với một số oxit kim loại
- Cho luồng khí hiđro đi qua ống nghiệm chứa bột đồng (II) oxit CuO màu đen.
- Ở nhiệt độ thường: không thấy có phản ứng hóa học xảy ra.
- Khi đốt nóng ống nghiệm: bột CuO màu đen chuyển dần thành lớp đồng màu đỏ gạch. (H_{2} + CuO overset{t^{circ}}{rightarrow} H_{2}O + Cu)
- Khí hiđro đã chiếm khí oxi trong hợp chất CuO. Hiđro có tính khử
Kết luận tính chất của hidro
Ở nhiệt độ thích hợp, khí hiđro không những kết hợp được với oxi, mà nó còn có thể kết hợp được với nguyên tố oxi trong một số oxit kim loại. Khí hiđro có tính khử.
Cách điều chế hidro như nào?
Trong phòng thí nghiệm
- Nguyên tắc: Cho axit tác dụng với kim loại (H_{2}SO_{4} + Zn rightarrow ZnSO_{4} + H_{2})
Trong công nghiệp
- Điện phân nước: (2H_{2}Ooverset{dp}{rightarrow} 2H_{2} + O_{2})
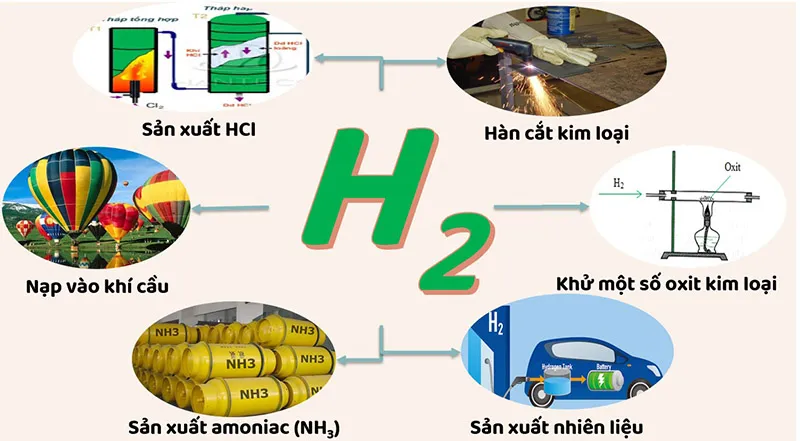
Những ứng dụng của hidro
Khí hiđro có nhiều ứng dụng, chủ yếu do tính chất rất nhrj, do tính khử và khi cháy tỏa ra nhiều nhiệt.
- Làm nhiên liệu.
- Nguyên liệu để sản xuất (NH_{3}, HCl) chất hữu cơ.
- Khử oxit kim loại thành kim loại.
- Bơm bóng, khí cầu.
- Hàn cắt kim loại.
Tìm hiểu thêm: Dãy hoạt động hóa học của kim loại là gì? Bài tập Hóa lớp 9
>>>>>Xem thêm: Hợp chất hữu cơ là gì? Phân loại, ứng dụng của hợp chất hữu cơ
Một số dạng bài tập về hiđro
Ví dụ 1: Hoàn thành phương trình hóa học của những phản ứng giữa các chất sau:
- (H_{2} + Fe_{3}O_{4} rightarrow … + …)
- (H_{2} + PbO rightarrow … + …)
- (2H_{2} + CO_{2} rightarrow … + …)
Cách giải:
- (4H_{2} + Fe_{3}O_{4} rightarrow 3Fe + 4H_{2}O)
- (H_{2} + PbO rightarrow H_{2}O + Pb)
- (2H_{2} + CO_{2} rightarrow C + 2H_{2}O)
Ví dụ 2: Có một hỗn hợp gồm 60% (Fe_{2}O_{3}) và 40% CuO về khối lượng. Người ta dùng (H_{2}) (dư) để khử 20 g hỗn hợp đó.
- Tính khối lượng Fe và khối lượng Cu thu được sau phản ứng.
- Tính số mol (H_{2}) đã tham gia phản ứng.
Cách giải:
- Khối lượng (Fe_{2}O_{3})trong 20 g hỗn hợp : (20 × 60) : 100 = 12(g)
(n_{Fe_{2}O_{3}} = frac{12}{160} = 0,075, (mol))
- Khối lượng Cu trong 20 g hỗn hợp : (20 × 40) : 100 = 8(g)
(n_{Cu} = frac{8}{80} = 0,1, (mol))
- Phương trình hóa học của phản ứng khử (H_{2}) của (Fe_{2}O_{3})
(2Fe_{2}O_{3} + 3H_{2} rightarrow 4Fe + 6H_{2}O)
- Theo phương trình hóa học trên , ta có :
(m_{Fe} = 0,15 . 56 = 8,4, (g))
- Phương trình hóa học của phản ứng khử (H_{2}) của CuO
(H_{2} + CuO overset{t^{circ}}{rightarrow} H_{2}O + Cu)
- Theo phương trình hóa học trên , ta có :
(m_{Cu} = 0,1.64 = 6,4, (g))
- (m_{H_{2}} = (0,1 + 0,1125) .2 = 0,325)
Ví dụ 3: Có 4 bình đựng riêng các khí sau: không khí, khí oxi, khí hiđro, khí cacbonic. Bằng cách nào để nhận biết các chất khí trong mỗi lọ ? Giải thích và viết các phương trình hoá học (nếu có).
Cách giải:
- Cho các khí trên qua nước vôi trong (Ca(OH)_{2}) dư, khí nào làm đục nước vôi trong là khí (CO_{2}).
(CO_{2} + Ca(OH)_{2} rightarrow CaCO_{3} + H_{2}O)
- Lấy que đóm đầu có than hồng cho vào các khí còn lại, khí nào làm bùng cháy que đóm, khí đó là khí oxi.
- Cho các khí còn lại qua CuO nung nóng, khí nào làm xuất hiện Cu (màu đỏ) là khí (H_{2})
.(H_{2} + CuO overset{t^{circ}}{rightarrow} H_{2}O + Cu)
- Chất khí còn lại không phản ứng là không khí.
Như vậy qua bài viết trên đây, Gockhampha.edu.vn.COM.VN đã cung cấp cho bạn định nghĩa hiđro là gì, tính chất của hidro, cách điều chế và ứng dụng của hidro. Hy vọng với những thông tin về chủ đề tính chất của hidro sẽ hữu ích cho bạn trong quá trình nghiên cứu và học tập. Chúc bạn luôn học tốt!

