Phương trình hóa học sẽ thể hiện phản ứng hóa học. Vậy làm sao để lập phương trình hóa học một cách đầy đủ và chính xác nhất. Cùng Gockhampha.edu.vn.COM.VN tìm hiểu về các phương pháp đơn giản dưới đây sẽ giúp các bạn giải quyết các bài tập về lập phương trình hóa học từ cơ bản đến nâng caao một cách dễ dàng nhất.
Bạn đang đọc: Lập phương trình hóa học: Phương pháp đơn giản và Bài tập vận dụng
Contents
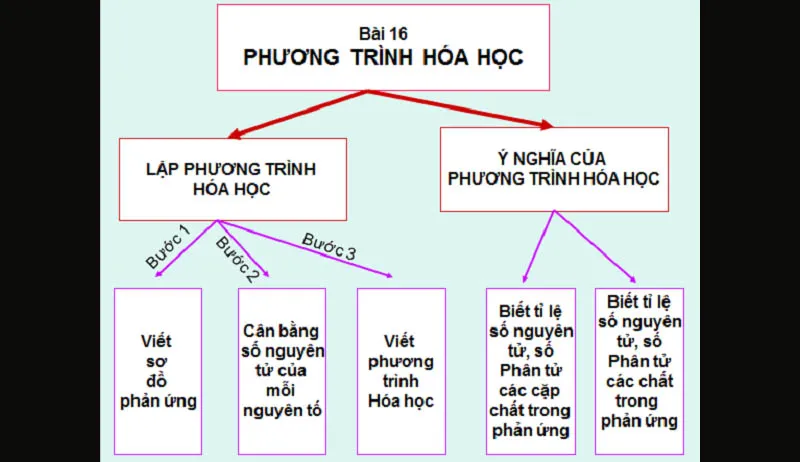
Lập phương trình hóa học và hướng giải
- Bước 1: Viết sơ đồ phản ứng dưới dạng công thức hóa học.
- Bước 2: Đặt hệ số sao cho số nguyên tử của mỗi nguyên tố ở hai vế bằng nhau.
- Bước 3: Hoàn thành phương trình.
Chú ý: Trong bước 2, thường sử dụng phương pháp “Bội chung nhỏ nhất” để đặt hệ số bằng cách như cụ thể như sau:
- Chọn nguyên tố có số nguyên tử ở hai vế chưa bằng nhau và có số nguyên tử nhiều nhất (cũng có trường hợp không phải như vậy).
- Tìm bội chung nhỏ nhất của các chỉ số nguyên tử nguyên tố đó ở hai vế, đem bội chung nhỏ nhất chia cho chỉ số thì ta có hệ số.
- Trong quá trình cân bằng không được thay đổi các chỉ số nguyên tử trong các công thức hóa học.
Tìm hiểu thêm: Monome là gì? Monome thường gặp, điều chế polime từ monome
>>>>>Xem thêm: Nhận biết một số chất khí: Tổng hợp Lý thuyết và Một số dạng bài tập
Các phương pháp cân bằng cụ thể để lập phương trình hóa học
Phương pháp chẵn – lẻ
Nội dung của phương pháp chẵn – lẻ chính là thêm hệ số vào trước chất có chỉ số lẻ để làm chẵn số nguyên tử của nguyên tố đó.
Ví dụ 1: Cân bằng và lập phương trình hóa học theo phương pháp chẵn – lẻ
- Al + HCl → AlCl3 + H2
Ta chỉ việc thêm hệ số 2 vào trước AlCl3 để cho số nguyên tử Cl chẵn. Khi đó, vế phải có 6 nguyên tử. Cl trong 2AlCl3, nên vế trái thêm hệ số 6 trước HCl.
- Al + 6HCl → 2AlCl3 + H2
Vế phải có 2 nguyên tử Al trong 2AlCl3, vế trái ta thêm hệ số 2 trước Al.
- 2Al + 6HCl → 2AlCl3 + H2
Vế trái có 6 nguyên tử H trong 6HCl, nên vế phải ta thêm hệ số 3 trước H2.
- 2Al + 6HCl → 2AlCl3 + 3 H2
Ví dụ 2: Cân bằng và lập phương trình hóa học theo phương pháp chẵn – lẻ
- KClO3 → KCl + O2
Ta thấy số nguyên tử oxi trong O2 là số chẵn và trong KClO3 là số lẻ nên đặt hệ số 2 trước công thức KClO3.
- 2KClO3 → KCl + O2
Tiếp theo cân bằng số nguyên tử K và Cl, đặt hệ số 2 trước KCl.
- 2KClO3 → 2KCl + O2
Cuối cùng ta chỉ cần cân bằng số nguyên tử oxi nên đặt hệ số 3 trước O2.
- 2KClO3 → 2KCl + 3O2
Ví dụ 3: Cân bằng và lập phương trình hóa học theo phương pháp chẵn – lẻ
- Al + O2 → Al2O3
Số nguyên tử oxi trong Al2O3là số lẻ nên thêm hệ số 2 vào trước nó.
- Al + O2 → 2Al2O3
Khi đó, số nguyên tử Al trong 2Al2O3là 4. Ta thêm hệ số 4 vào trước Al.
- 4 Al + O2 → 2Al2O3
Cuối cùng cân bằng số nguyên tử oxi, vế phải số nguyên tử oxi trong 2Al2O3là 6, vế trái ta thêm hệ số 3 trước O2.
- 4Al + 3O2 → 2Al2O3
Phương pháp đại số
Lập phương trình hóa học theo phương pháp đại số thì thường sử dụng cho các phương trình khó cân bằng bắng phương pháp trên, thông thường sử dụng đối với học sinh giỏi.
- Bước 1: Đưa các hệ số hợp thức a, b, c, d, e, f, … lần lượt vào các công thức ở hai vế của phương trình phản ứng.
- Bước 2: Cân bằng số nguyên tử ở 2 vế của phương trình bằng một hệ phương trình chứa các ẩn: a, b, c, d, e, f, g….
- Bước 3: Giải hệ phương trình vừa lập để tìm các hệ số.
- Bước 4: Đưa các hệ số vừa tìm vào phương trình phản ứng.
Ví dụ 1: Cu + H2SO4 đặc, nóng → CuSO4 + SO2 + H2O (1)
- Bước 1: aCu + bH2SO4 đặc, nóng→ cCuSO4 + dSO2 + eH2O
- Bước 2: Tiếp theo lập hệ phương trình dựa vào mối quan hệ về khối lượng giữa các chất trước và sau phản ứng, như vậy khối lượng nguyên tử của mỗi nguyên tố ở 2 vế phải bằng nhau.
Cu: a = c (1)
S: b = c + d (2)
H: 2b = 2e (3)
O: 4b = 4c + 2d + e (4)
- Bước 3: Giải hệ phương trình bằng cách:
Từ pt (3), chọn e = b = 1 (ta có thể chọn bất kỳ hệ số khác).
Từ pt (2), (4) và (1) => c = a = d = ½ => c = a = d = 1; e = b =2 (vậy là ta đang quy đồng mẫu số).
- Bước 4: Đưa các hệ số vừa tìm vào phương trình phản ứng, ta được phương trình hoàn chỉnh. Cu + 2H2SO4 đặc, nóng→CuSO4 + SO2 + 2H2O
Bài tập vận dụng khi lập phương trình hóa học
Bài 1: Cân bằng và lập phương trình hóa học dưới đây
1) Cu(OH)2 + HCl → CuCl2 + H2O
2) FeO + HCl → FeCl2 + H2O
3) Cu(NO3)2 + NaOH → Cu(OH)2 + NaNO3
4) N2 + O2 → NO
5) NO2 + O2 + H2O → HNO3
6) N2O5 + H2O → HNO3
7) Al2 (SO4)3 + NaOH → Al(OH)3 + Na2SO4
8) CaO + H2O → Ca(OH)2
9) Na + H3PO4 → Na2HPO4 + H2
10) Na + H3PO4 → NaH2PO4 + H2
11) C4H10 + O2 → CO2 + H2O
12) C6H5OH + Na → C6H5ONa + H2
Lời giải
1) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
2) FeO + 2HCl → FeCl2 + H2O
3) Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
4) N2 + O2 → 2NO
5) 4NO2 + O2 + 2H2O → 4HNO3
6) N2O5 + H2O → 2HNO3
7) Al2 (SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
8) CaO + H2O → Ca(OH)2
9) 2Na + H3PO4 → Na2HPO4 + H2
10) 2Na + 2H3PO4 → 2NaH2PO4 + H2
11) 2C4H10 + 13O2 → 8CO2 + 10H2O
12) 2 C6H5OH + 2Na → 2C6H5ONa + H2
Bài 2: Cho sơ đồ của phản ứng như sau để lập phương trình hóa học
HgO → Hg + O2
=>Lập phương trình hóa học và hãy cho biết tỉ lệ số nguyên tử và số phân tử của các chất trong mỗi phản ứng.
Lời giải:
2HgO → 2Hg + O2
Tỉ lệ: số phân tử HgO: số nguyên tử Hg: số phân tử O2 = 2 : 2 : 1.
Bài 3: Hãy lập phương trình hóa học của các phản ứng dưới đây
1) CnH2n + O2 → CO2 + H2O
2) CnH2n – 2 + O2 → CO2 + H2O
3) CnH2n + 2O + O2 → CO2 + H2O
4) CxHyOz + O2 → CO2 + H2O
5) CHx + O2 → COy + H2O
Trên đây là những kiến thức hữu ích về cách lập phương trình hóa học qua một số phương pháp đơn giản cũng như các bài tập ứng dụng thực tế, hi vọng đã cung cấp cho bạn những thông tin cần thiết để phục vụ cho quá trình học tập và nghiên cứu của bản thân. Nếu có bất cứ câu hỏi nào liên quan đến cách lập phương trình hóa học, mời bạn để lại nhận xét bên dưới để cùng Gockhampha.edu.vn.Com.VN tìm hiểu thêm nhé!

