Liên kết cộng hóa trị là một trong những liên phổ biến trong hoá học, chúng có vai trò quan trọng vì giúp các phân tử liên kết với nhau Vậy cụ thể Liên kết cộng hóa trị có cực là gì? Hãy cùng Gockhampha.edu.vn.Com.Vn tìm hiểu lý thuyết, bài tập liên quan về chủ đề trên nhé!
Bạn đang đọc: Liên kết cộng hóa trị là gì? Tổng hợp lý thuyết, bài tập liên quan
Contents
- 1 Liên kết cộng hóa trị là gì
- 2 Các loại liên kết cộng hóa trị
- 3 Tính chất của các chất có liên kết cộng hóa trị
- 4 Liên kết hóa trị hình thành giữa các nguyên tử giống nhau
- 5 Liên kết hóa trị hình thành giữa các nguyên tử khác nhau
- 6 Cách phân biệt liên kết cộng hóa trị và liên kết ion
- 7 Bài tập trắc nghiệm liên quan đến liên kết cộng hóa trị
Liên kết cộng hóa trị là gì
Liên kết cộng hóa trị (còn được biết đến dưới tên liên kết phân tử) là một loại liên kết hóa học giữa hai nguyên tử hoặc ion, lúc này các cặp electron được chia sẻ với nhau. Mỗi nguyên tử hoặc ion trong hợp chất đó thường sẽ có độ âm điện tương đương nhau. Liên kết cộng hoá trị xuất hiện ở các chất có nhiều dạng khác nhau từ rắn, lỏng, khí.
Trong một liên kết cộng hóa trị, mỗi cặp electron được chia sẻ giữa hai nguyên tử được gọi là cặp liên kết. Ngược lại, cặp electron mà không được chia sẻ giữa hai nguyên tử được gọi là cặp đơn độc.
Thuật ngữ “cộng hóa trị” được vào danh sách thuật ngữ hoá học lần đầu tiên vào năm 1939. Mặc dù từ năm 1919, Irving Langmuir đã sử dụng khái niệm “cộng hóa trị” để mô tả các chất chia sẻ electron giữa các nguyên tử lân cận.
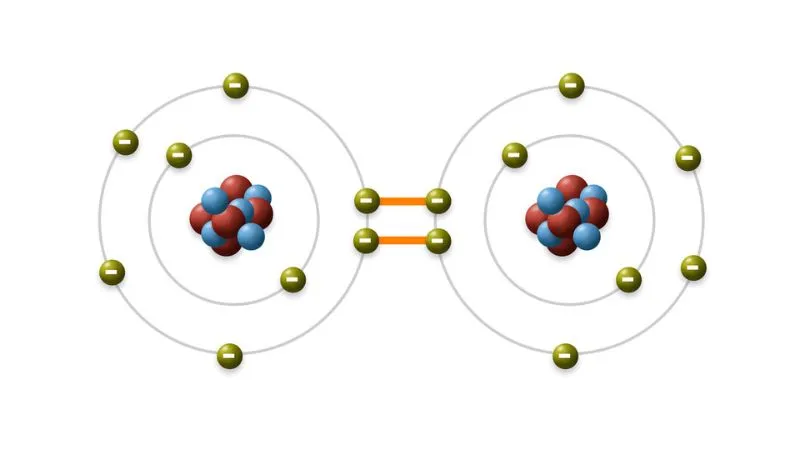
Các loại liên kết cộng hóa trị
Liên kết cộng hóa trị có cực
Liên kết cộng hóa trị có cực là một dạng liên kết cộng hóa trị trong đó việc chia sẻ electron giữa hai nguyên tử không đều nhau. Điều này xảy ra khi hai nguyên tử có độ âm điện khác nhau. Nguyên tử có độ âm điện cao hơn sẽ thu hút các electron chia sẻ nhiều hơn, dẫn đến việc tạo ra một phân cực điện tích.
Ví dụ: trong phân tử nước (H2O), nguyên tử oxi có độ âm điện cao hơn so với nguyên tử hydro, do đó oxi thu hút các electron chia sẻ hơn. Điều này tạo ra một đầu dương (các nguyên tử hydro) và một đầu âm (nguyên tử oxi), tạo ra một liên kết cộng hóa trị có cực.
Liên kết cộng hóa trị có cực có một số tác động quan trọng đối với tính chất vật lý và hóa học của chất, bao gồm tính tan, điểm sôi và nhiệt độ nóng chảy.
Liên kết cộng hóa trị không cực
Liên kết cộng hóa trị không cực là một loại liên kết trong đó hai nguyên tử chia sẻ một cặp electron một cách đồng đều. Nguyên nhân chính là do hai nguyên tử trong liên kết có độ âm điện tương đương nhau.
Một ví dụ điển hình về liên kết cộng hóa trị không cực là liên kết giữa hai nguyên tử hydro trong một phân tử hydro. Độ âm điện giữa các nguyên tử là giống nhau. Do đó, các electron liên kết được chia sẻ một cách đồng đều.
Liên kết cộng hóa trị không cực cũng ảnh hưởng đến tính chất vật lý và hóa học của chất, nhưng thường khác so với những chất có liên kết cộng hóa trị có cực.
Liên kết đơn phân tử
Liên kết đơn phân tử là loại liên kết hai phân tử đều chia sẻ một cặp electron duy nhất. Đây được xem là loại liên kết có tính ổn định nhất do có mức độ phản ứng thấp, đồng nghĩa với việc là các e sẽ ít bị mất đi nếu gặp phải các chất khác.
Liên kết đơn phân tử là dạng liên kết phổ biến nhất trong hóa học, tạo ra nhiều hợp chất khác nhau. Đồng thời, đây cũng là dạng liên kết yếu nhất so với liên kết kép và liên kết ba.

Liên kết đôi phân tử
Liên kết đôi phân tử hay còn được gọi là liên kết cộng hóa trị đôi. Là một loại liên kết trong đó hai cặp electron được chia sẻ giữa hai nguyên tử. Liên kết đôi phân tử thường xảy ra khi cả hai nguyên tử cần thêm hai electron để hoàn thành cấu hình electron ổn định của chúng.
Một ví dụ điển hình của liên kết đôi phân tử là một nguyên tử cacbon và một nguyên tử oxi trong một phân tử carbon dioxide (CO2). Mỗi nguyên tử lúc này sẽ chia sẻ hai electron với nguyên tử kia, tạo thành một liên kết đôi phân tử.
Liên kết đôi phân tử mạnh hơn liên kết đơn phân tử do chia sẻ nhiều electron hơn, nhưng yếu hơn liên kết ba phân tử (trong đó ba cặp electron được chia sẻ).

Liên kết ba phân tử
Liên kết ba phân tử hay còn được gọi là liên kết cộng hóa trị ba. Là loại liên kết mà ở đó ba cặp electron được chia sẻ giữa hai nguyên tử. Liên kết ba phân tử mạnh hơn cả liên kết đơn và liên kết đôi do số lượng electron được chia sẻ nhiều hơn.
Một ví dụ điển hình về liên kết ba phân tử là liên kết giữa hai nguyên tử nitơ trong một phân tử nitơ (N2). Trong trường hợp này, mỗi nguyên tử nitơ chia sẻ ba electron với nguyên tử kia, tạo thành một liên kết ba phân tử.
Tìm hiểu thêm: Liên kết ion là gì? Tìm hiểu sự hình thành liên kết ion

Tính chất của các chất có liên kết cộng hóa trị
Trạng thái tự nhiên: Các chất cộng hóa trị có thể xuất hiện ở tất cả ba trạng thái của chất: rắn, lỏng và khí. Điều này phụ thuộc vào sức mạnh của liên kết cộng hóa trị cũng như các liên kết phân tử giữa các phân tử riêng lẻ.
Điểm nóng chảy và điểm sôi: Các chất cộng hóa trị thường có điểm nóng chảy và điểm sôi thấp hơn so với các chất ion hoặc cơ sở hữu cơ. Điều này là do các liên kết phân tử giữa các phân tử riêng lẻ thường yếu hơn so với liên kết ion hoặc liên kết kim loại.
Ở những chất có cực : sẽ tan nhiều trong dung môi có cực như nước.
Ở những chất không cực: tan trong những dung môi không cực như cacbon tetraclorua, benzen,… riêng các chất chỉ có liên kết cộng hóa trị không cực thì sẽ không có khả năng dẫn điện ở mọi trạng thái.
Liên kết hóa trị hình thành giữa các nguyên tử giống nhau
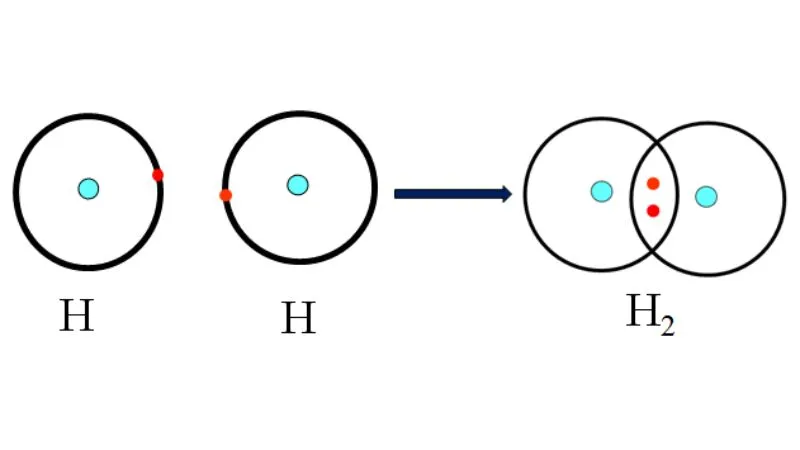
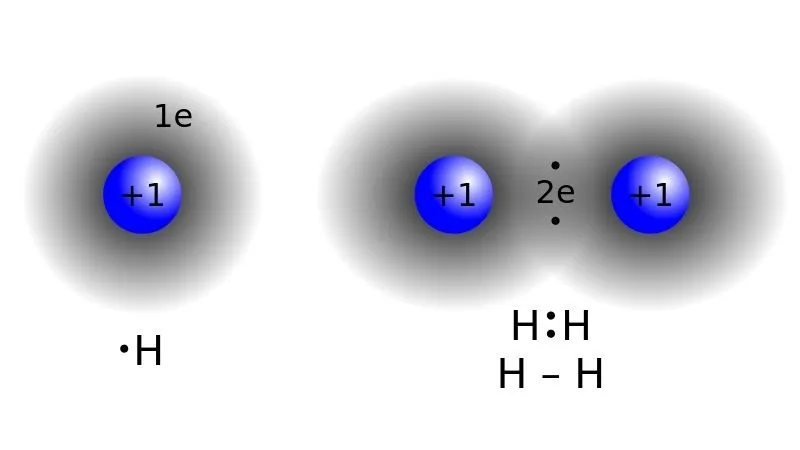
Sự hình thành của phân tử hidro
Theo lý thuyết liên kết cộng hóa trị, phân tử hidro (H2) hình thành khi hai nguyên tử hidro chia sẻ một cặp electron để tạo thành liên kết cộng hóa trị đơn giữa chúng.
Cụ thể, trong nguyên tử hidro, mỗi nguyên tử chỉ có một electron trong lớp ngoài cùng và cần thêm một electron để đạt được cấu hình electron ổn định. Do đó, hai nguyên tử hidro liên kết với nhau để chia sẻ một cặp electron, điều này giúp cả hai nguyên tử đạt được cấu hình electron ổn định.
Sự hình thành của phân tử nitơ
Theo lý thuyết liên kết cộng hóa trị, phân tử nitơ (N2) hình thành khi hai nguyên tử nitơ chia sẻ ba cặp electron để tạo thành liên kết cộng hóa trị ba giữa chúng. Mỗi nguyên tử nitơ cung cấp ba electron, tạo thành ba cặp electron được chia sẻ.
Cụ thể, trong nguyên tử nitơ, mỗi nguyên tử có năm electron trong lớp ngoài cùng của nó, và cần thêm ba electron để đạt được cấu hình electron ổn định. Do đó, hai nguyên tử nitơ liên kết với nhau để chia sẻ ba cặp electron, điều này giúp cả hai nguyên tử đạt được cấu hình electron ổn định.

Liên kết hóa trị hình thành giữa các nguyên tử khác nhau
Sự hình thành của phân tử hidro clorua
Theo lý thuyết liên kết cộng hóa trị, phân tử hidro clorua (HCl) hình thành khi một nguyên tử hidro và một nguyên tử clo chia sẻ một cặp electron để tạo thành liên kết cộng hóa trị đơn giữa chúng. Nguyên tử hidro cung cấp một electron và nguyên tử clo cũng cung cấp một electron, tạo thành một cặp electron được chia sẻ.
Trong nguyên tử hidro, có một electron trong lớp ngoài cùng và cần thêm một electron để đạt được cấu hình electron ổn định. Còn đối với nguyên tử clo, có bảy electron trong lớp ngoài cùng, và cần thêm một electron để đạt được cấu hình electron ổn định. Do đó, nguyên tử hidro và nguyên tử clo liên kết với nhau để chia sẻ một cặp electron, giúp cả hai nguyên tử đạt được cấu hình electron ổn định.
Đây là một liên kết cộng hóa trị đơn, vì chỉ có một cặp electron được chia sẻ. Liên kết này giữa nguyên tử hidro và nguyên tử clo tạo thành một phân tử hidro clorua ổn định.

Sự hình thành của phân tử cacbon dioxit
Theo lý thuyết liên kết cộng hóa trị, phân tử cacbon dioxit (CO2) hình thành từ việc một nguyên tử cacbon kết hợp với hai nguyên tử oxi thông qua liên kết cộng hóa trị đôi.
Trong nguyên tử cacbon, có bốn electron trong lớp ngoài cùng và cần thêm bốn electron để đạt được cấu hình electron ổn định. Trong mỗi nguyên tử oxi, có sáu electron trong lớp ngoài cùng, và cần thêm hai electron để đạt được cấu hình electron ổn định. Do đó, nguyên tử cacbon liên kết với mỗi nguyên tử oxi bằng cách chia sẻ hai cặp electron, tạo thành liên kết cộng hóa trị đôi. Mỗi nguyên tử oxi cung cấp hai electron, và nguyên tử cacbon cũng cung cấp hai electron cho mỗi liên kết, điều này giúp cả ba nguyên tử đạt được cấu hình electron ổn định.

>>>>>Xem thêm: Nhận biết một số chất khí: Tổng hợp Lý thuyết và Một số dạng bài tập
Cách phân biệt liên kết cộng hóa trị và liên kết ion
Dưới đây là một bảng so sánh giữa liên kết cộng hóa trị và liên kết ion:
| Liên kết cộng hóa trị | Liên kết ion | |
|---|---|---|
| Cách hình thành | Hai nguyên tử chia sẻ một hoặc nhiều cặp electron. | Một nguyên tử truyền (cho hoặc nhận) electron đến một nguyên tử khác, tạo ra hai ion với các điện tích khác nhau mà thu hút lẫn nhau. |
| Vị trí trong bảng tuần hoàn | Thường hình thành giữa các nguyên tử phi kim. | Thường hình thành giữa các nguyên tử kim loại và phi kim. |
| Độ dẫn điện | Thường không dẫn điện. | Dẫn điện tốt khi tan trong nước hoặc nóng chảy do sự tự do của các ion. |
| Điểm nóng chảy và điểm sôi | Có điểm nóng chảy và điểm sôi thấp hơn do liên kết yếu hơn giữa các phân tử. | Thường có điểm nóng chảy và điểm sôi cao do liên kết mạnh giữa các ion. |
| Tính chất hóa học | Thường tan trong các dung môi phi cực hoặc ít cực. | Thường tan tốt trong nước và các dung môi phân cực khác. |
| Hình dạng phân tử | Có hình dạng phân tử định rõ. | Không có hình dạng phân tử định rõ, thay vào đó, các ion sắp xếp thành một kết cấu lưới mạng. |
Bài tập trắc nghiệm liên quan đến liên kết cộng hóa trị
Câu 1: Hai nguyên tử liên kết với nhau bằng liên kết cộng hoá trị khi
A. 2 ion có điện tích trái dấu tiến gần vào nhau.
B. mỗi nguyên tử góp chung e để tạo nên một hay nhiều cặp e chung.
C. 2 nguyên tử với độ âm điện khác nhau rất lớn tiến gần vào nhau.
D. 2 ion với điện tích trái dấu hút nhau bởi lực hút tĩnh điện.
Câu 2: Loại liên kết nào tồn tại trong phân tử N2?
A. Liên kết ion
B. LKCHT không cực.
C. Liên kết cho – nhận
D. LKCHT phân cực
Câu 3: LKCHT tồn tại do
A. các đám mây e.
B. các e hoá trị.
C. các cặp e dùng chung.
D. lực hút tĩnh điện yếu hình thành giữa các nguyên tử.
Câu 4: Cho 2 nguyên tố: A (Với Z= 8), B (Với Z = 6). Hợp chất của A và B có dạng là BA2, trong hợp chất này có loại liên kết là?
A. LKCHT
B. Liên kết ion.
C. Liên kết H2
D. Liên kết giữa các kim loại
Câu 5: Cặp nguyên tử nào sau đây tạo hợp chất có LKCHT?
A. K và Cl
B. O và Al
C. Cl và C
D. F và Li.
Câu 6: Khi nói đến hợp chất cộng hóa trị, ý nào sai trong các ý sau đây?
A. Các chất chỉ có LKCHT không cực không thể dẫn điện ở mọi trạng thái.
B. Các chất có cực như đường, etanol… sẽ tan nhiều trong các dung môi có cực.
C. Các chất mà phân tử chỉ có LKCHT có thể tồn tại ở thể rắn như lưu huỳnh ,đường, iot,…
D. Hầu hết các chất không cực như lưu huỳnh, iot,… là các chất không tan trong dung môi có cực.
Câu 7: Liên kết hoá học xảy ra trong phân tử HCl là:
A. Liên kết ion.
B. LKCHT không phân cực
C. LKCHT phân cực.
D. Liên kết cho – nhận
Câu 8: Phát biểu nào là sai?
A. Phân tử NH3 có 3 LKCHT phân cực.
B. Phân tử NH3 là phân tử bị phân cực.
C. Phân tử NH3 có 3 LKCHT không phân cực.
D. Trong phân tử NH3, nguyên tử N còn một cặp e lớp ngoài cùng không tham gia liên kết.
Câu 9: Hầu hết các hợp chất cộng hóa trị mang đặc điểm là :
A. có khả năng hòa tan trong dung môi hữu cơ.
B. nhiệt độ sôi và nhiệt độ nóng chảy cao.
C. có thể dẫn điện khi ở thể nóng chảy hoặc thể lỏng.
D. Hòa tan trong nước tạo nên dung dịch điện li.
Câu 10: Sắp xếp dãy chất nào đúng theo chiều tăng dần sự phân cực liên kết trong phân tử?
A. HCl, NaBr, N2.
B. NaBr, HCl, N2.
C. N2, HCl, NaBr.
D. NaBr, N2, HCl.
Đáp án tham khảo:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | B | C | A | C | D | C | C | A | D |
Như vậy, bài viết trên đây của Gockhampha.edu.vn.Com.Vn đã giúp bạn tổng hợp kiến thức về chuyên đề liên kết cộng hóa trị. Hy vọng với những thông tin trong bài viết, bạn đã có thể trả lời được liên kết cộng hóa trị có cực là gì, liên kết cộng hóa trị không cực là gì, cách vẽ liên kết cộng hóa trị cũng như khái niệm tổng quát liên kết cộng hóa trị là gì. Chúc bạn luôn học tốt!
Xem chi tiết qua video:

