Lưu huỳnh trioxit được biết đến là một chất lỏng không màu, tan vô hạn trong nước và mang đầy đủ các tính chất của một oxit axit. Trong nội dung bài viết dưới đây, hãy cùng Gockhampha.edu.vn.COM.VN tìm hiểu chi tiết chủ đề này qua bài viết dưới đây nhé!.
Bạn đang đọc: Lưu huỳnh trioxit là gì? Tính chất, Ứng dụng và Cách điều chế
Contents
Lưu huỳnh trioxit là gì?
Định nghĩa
Lưu huỳnh trioxit là một hợp chất hóa học với công thức SO3
Trioxit lưu huỳnh khô tuyệt đối không ăn mòn kim loại.
Ở thể khí, đây là một chất gây ô nhiễm nghiêm trọng và là tác nhân chính trong các trận mưa axit.
Ngoài ra SO3 được sản xuất đại trà để dùng trong điều chế axit sulfuric.
Cấu tạo phân tử
Nguyên tử S có cấu hình electron lớp ngoài cùng là: …3s23p43d0 được phân bố trong các orbitan:
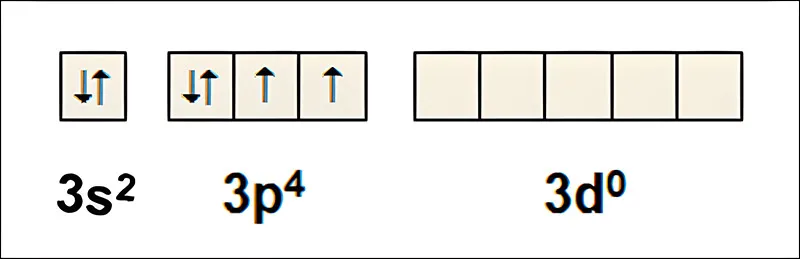
Ở trạng thái kích thích có cấu hình e lớp ngoài là: …3s13p33d2 được phân bố như sau:
Tìm hiểu thêm: Hóa trị là gì? Cách tính hóa trị và bài tập ví dụ
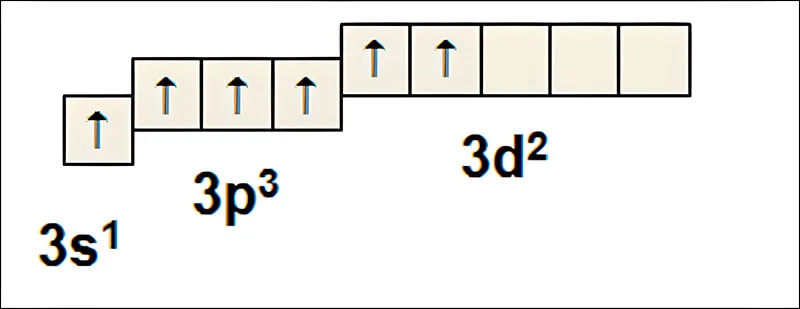
Như vậy, S có 6 e độc thân ⇒ có thể liên kết với 6 e độc thân của 3 nguyên tử O tạo ra 6 liên kết cộng hóa trị. Mỗi nguyên tử O liên kết với nguyên tử S bằng một liên kết đôi.
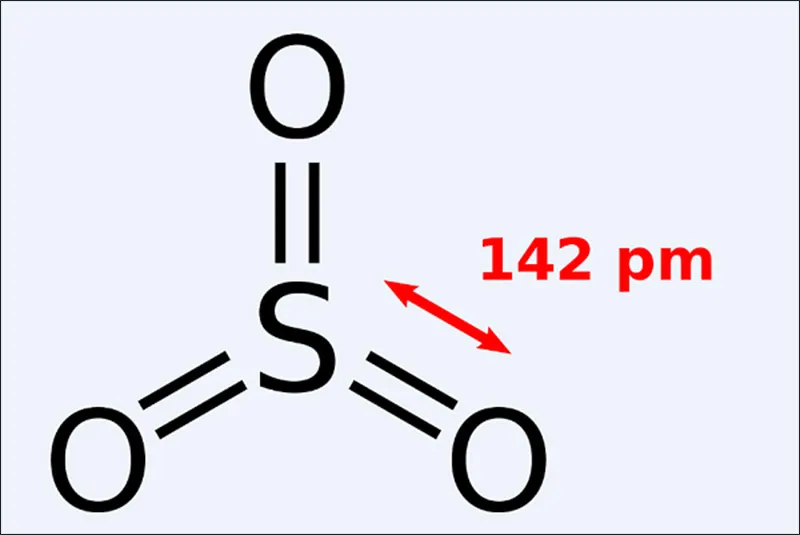
Theo quy tắc bát tử, công thức cấu tạo của SO3 được viết là:
>>>>>Xem thêm: Định nghĩa năng lượng ion hóa của một nguyên tử hay một phân tử
⇒ Trong hợp chất SO3, nguyên tố S có số oxi hoá cực đại là + 6.
Tính chất vật lý của lưu huỳnh trioxit
Lưu huỳnh trioxit là chất lỏng không màu, tan vô hạn trong nước và axit sunfuric.
- Khối lượng phân tử: 80,06g/mol
- Nhiệt độ nóng chảy: 16,9∘C
- Nhiệt độ sôi: 45∘C
Tính chất hóa học của lưu huỳnh trioxit
Lưu huỳnh trioxit có đầy đủ các tính chất của một oxit axit
Nhiệt phân lưu huỳnh trioxit với xúc tác V2O5
2SO3⇌O2+2SO2
Tác dụng rất mạnh với nước tạo thành axit sunfuric
SO3+H2O→H2SO4
Tác dụng với bazơ tạo thành muối và nước
NaOH+SO3→NaHSO4
2NaOH+SO3→H2O+Na2SO4
Tác dụng với oxit bazơ (tan) tạo thành muối
CaO+SO3→CaSO4
Na2O+SO3→Na2SO4
Tác dụng với H2SO4
Lưu huỳnh trioxit tan vô hạn trong H2SO4 tạo oleum H2SO4.nSO3
H2SO4+nSO3→H2SO4.nSO3
Lưu huỳnh trioxit tác dụng với H2SO4 tạo ra axit disunfuric
H2SO4+SO3→H2S2O7
Lưu huỳnh trioxit có tính khử không?
Vì trong SO3 số OXH của S đã ở mức cao nhất (+6) nên SO3 không có tính khử mà chỉ thể hiện tính OXH (nhận e)
Ví dụ:
- 2SO3+2NH3→3SO2+N2+3H2O
- S+6+2e→S+4
- SO2−3 lại vừa thể hiện tính OXH vừa thể hiện tính khử vì số OXH của lưu huỳnh trong SO2−3 ở mức trung bình (+4)
- 2KMnO4+5K2SO3+3H2SO4→2MnSO4+6K2SO4+3H2O
- S+4→S+6+2e
- Fe2(SO3)3+3Na2S→2Fe(OH)3+H2S+3Na2SO4
- S+4+6e→S−2
Ứng dụng và cách điều chế lưu huỳnh trioxit
Ứng dụng
Lưu huỳnh trioxit ít có ứng dụng trong thực tế, nhưng lại là sản phẩm trung gian để sản xuất axit sunfuric.
Cách điều chế
Trong công nghiệp người ta sản xuất SO3 bằng cách oxi hóa lưu huỳnh đioxit:
4FeS2+11O2→2Fe2O3+8SO2
2SO2+O2→2SO3
Cách nhận biết SO2 và SO3
Có thể nhận biết SO2 và SO3 bằng các cách sau:
Dùng thuốc thử là dung dịch Br2
Chất làm dung dịch Br2 mất màu là SO2
Br2+2H2O+SO2→H2SO4+2HBr
Chất còn lại là SO3
Dùng thuốc thử là dung dịch KMnO4
Chất làm dung dịch KMnO4 mất màu là SO2
2H2O+2KMnO4+5SO2→2H2SO4+2MnSO4+K2SO4
Chất không có hiện tượng gì là SO3
Dùng thuốc thử là dung dịch BaCl2
Chất tác dụng với BaCl2 tạo kết tủa trắng là SO3
BaCl2+H2O+SO3→2HCl+BaSO4
Chất không có hiện tượng gì là SO2
Bài tập về lưu huỳnh trioxit
Bài 1: Tính lượng FeS2 cần dùng để điều chế một lượng SO3 đủ để hòa tan vào 100 gam H2SO4 91%. Giả sử các phản ứng xảy ra hoàn toàn.
Cách giải:
Trong 100 gam dung dịch có:
mH2SO4=91gam và mH2O=9gam
Ta có phương trình phản ứng
SO3+H2O→H2SO4
→nSO3=nH2O=0,5mol
→mH2SO4=140(gam)
Gọi lượng SO3 tạo oleum là x mol
→80×140+80x.100 = 12,5%
⇒x=0,25
⇒nSO3=0,75
nFeS2=0,375
mFeS2=45gam
Bài 2: Tính khối lượng SO3 và H2SO4 20,5% cần lấy để pha chế được 340 gam dung dịch H2SO4 49%
Cách giải:
Gọi khối lượng của SO3 là a →nSO3=a80
Khối lượng của H2SO4 là b →mH2SO4=0,205b
⇒a+b=340 (1)
Ta có phương trình phản ứng:
SO3+H2O→H2SO4a80a80
→mH2SO4=98a80+0,205b
→98a80+0,205b = 340.49% (2)
Từ (1) và (2) ⇒{a=95b=245
Như vậy, bài viết trên đây của Gockhampha.edu.vn.VN đã giúp bạn tổng hợp kiến thức về lưu huỳnh trioxit SO3. Chúc bạn luôn học tập tốt!

