Kiến thức về phản ứng trung hòa là một trong những chủ đề trọng tâm của chương trình hóa học THCS. Trong bài viết dưới đây, hãy cùng Gockhampha.edu.vn.COM.VN tìm hiểu chi tiết về chủ đề trên nhé!.
Bạn đang đọc: Phản ứng trung hòa là gì? Định nghĩa, Cách phân loại và Bài tập
Contents
Tìm hiểu phản ứng trung hòa là gì?
Định nghĩa phản ứng trung hòa
Phản ứng trung hòa là phản ứng giữa 1 axit với 1 bazơ sao cho sau khi phản ứng kết thúc dung dịch thu được (gồm muối và nước) không còn tính axit hay bazơ nữa nghĩa là số mol axit = số mol bazơ trong phản ứng.
Điều kiện xảy ra phản ứng trung hòa
- Phản ứng trung hòa thuộc loại phản ứng trao đổi, vì vậy điều kiện xảy ra phản ứng trung hòa cũng chính là điều kiện xảy ra phản ứng trao đổi
- Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí hoặc nước.
Ví dụ về phản ứng trung hòa
CuSO4+ 2NaOH→ Na2SO4+ Cu(OH)2
K2SO4+ NaOH: Phản ứng không xảy ra.
Hiệu ứng nhiệt của phản ứng trung hòa
Thí nghiệm: Xác định hiệu ứng nhiệt của phản ứng trung hòa NaCl và NaOH
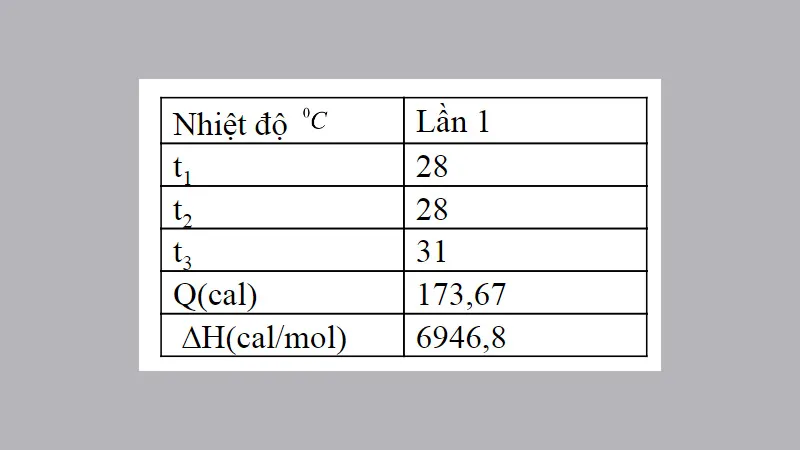
Nếu t1≠t2 thì Δt tính bằng hiệu số giữa t3 và (t1+t2)/2
Ta có:
Q= (m0c0+mHClcHCl+mNaClcNaCl) (t3–(t1+t2)/ 2)
Q= (7,89+25+25) (31– (28+28)/ 2)= 173,67cal
Nguyên lý của phản ứng trung hòa
- Đầu tiên, phải nhấn mạnh rằng nếu một phản ứng trung hòa được bắt đầu với lượng axit và bazơ bằng nhau (tính bằng mol), khi phản ứng kết thúc, chỉ thu được một muối; nghĩa là, không có lượng axit hoặc bazơ còn lại.
- Ngoài ra, một tính chất rất quan trọng của các phản ứng axit-bazơ là pH, cho biết mức độ axit hoặc bazơ của dung dịch. Điều này được xác định bởi số lượng ion H+ tìm thấy trong các giải pháp đo.
- Mặt khác, có một số khái niệm về tính axit và tính cơ bản tùy thuộc vào các tham số được xem xét. Một khái niệm nổi bật là của Bronsted và Lowry, coi axit là một loài có khả năng hiến proton (H+) và một cơ sở là loài có khả năng chấp nhận chúng.
Cách phân loại phản ứng trung hòa
Axit mạnh + bazơ mạnh
Phản ứng đã cho giữa axit sunfuric và kali hydroxit trong môi trường nước được lấy làm ví dụ, theo phương trình sau:
H2SO4+ 2KOH→ K2SO4+ 2H2O
Có thể thấy rằng cả axit và hydroxit đều là chất điện ly mạnh do đó, chúng bị ion hóa hoàn toàn trong dung dịch. Độ pH của dung dịch này sẽ phụ thuộc vào chất điện ly mạnh chiếm tỷ lệ lớn hơn.
Axit mạnh + bazơ yếu
HNO3+ NH3→ NH4NO3
Trong trường hợp này, nước được sản xuất cùng với muối không được quan sát, bởi vì nó sẽ phải được biểu diễn dưới dạng:
HNO3+ NH+4+ OH−→ NH4NO3+ H2O
Vì vậy, nước có thể được quan sát như là một sản phẩm của phản ứng. Trong trường hợp này, dung dịch sẽ có độ pH cơ bản là axit.
Axit yếu + bazơ mạnh
CH3COOH+ NaOH→ CH3COONa+ H2O
Vì axit axetic là chất điện ly yếu, nó phân ly một phần, dẫn đến natri axetat và nước, dung dịch sẽ có pH cơ bản.
Axit yếu + bazơ yếu
Cuối cùng và như đã nêu ở trên, một bazơ yếu không thể trung hòa axit yếu. Không có điều ngược lại xảy ra. Cả hai loài đều bị thủy phân trong dung dịch nước và độ pH của dung dịch sẽ phụ thuộc vào “độ bền” của axit và bazơ.
Ví dụ về phản ứng trung hòa
Ví dụ kinh điển về sự trung hòa là phản ứng giữa axit và bazơ để tạo ra muối và nước: axit + bazơ → muối + nước
HCl+ NaOH→ NaCl+ H2O
Mũi tên phải chỉ ra phản ứng hoàn thành để tạo thành sản phẩm. Trong khi ví dụ cổ điển là hợp lệ, một biểu thức tổng quát hơn dựa trên lý thuyết axit-bazơ của Bronsted-Lowry là: AH+ B→ A+ BH
Một số ví dụ thường gặp về phản ứng trung hòa:
Ca(OH)2+H2SO4→ CaSO4+ 2H2O
6HCl+ CO2→ CaCO3+ H2O
Cu(OH)2+H2SO4→ CuSO4+ 2H2O
HCl+ KOH→ KCl+ H2O
Ca(HCO3)2+ H2SO4→ 2H2O+ 2CO2+ CaSO4
Một số bài tập phản ứng trung hòa
Lý thuyết cần nhớ
Axit đơn: HCl,HBr,HI,HNO3. Ta có nH= naxit
Axit đa: H2SO4,H3PO4,H2SO3. Ta có nH= 2naxit hoặc nH= 3naxit
Bazơ đơn: KOH, NaOH, LiOH. Ta có nOH= nbazo
Bazơ đa: Ba(OH)2,Ca(OH)2. Ta có nOH= 2nbazo
PTHH của phản ứng trung hoà: H++OH−→ H2O
Phương pháp giải
Bước 1: Viết các PTHH xảy ra.
Bước 2: Đặt ẩn số nếu bài toán là hỗn hợp.
Bước 3: Lập phương trình toán học
Bước 4: Giải phương trình toán học, tìm ẩn.
Bước 5: Tính toán theo yêu cầu của bài.
Lưu ý:
Khi gặp dung dịch hỗn hợp các axit tác dụng với hỗn hợp các bazơ thì dùng phương pháp đặt công thức tương đương cho axit và bazơ.
Đặt thể tích dung dịch cần tìm là V (lít)
Tìm V cần nhớ: nHX= nMOH
Các bài toán cụ thể
Cho từ từ dung dịch H2SO4 vào dung dịch NaOH thì có các phản ứng xảy ra:
Phản ứng ưu tiên tạo ra muối trung hoà trước
H2SO4+ 2NaOH→ Na2SO4+ H2O (1)
Sau đó khi số mol H2SO4 = số mol NaOH thì có phản ứng
H2SO4+ NaOH→ NaHSO4+ H2O (2)
Cách giải: Xét tỷ lệ số mol để viết PTHH xảy ra.
Đặt T= nNaOH/ nH2SO4
- Nếu T thì chỉ có phản ứng (2) và có thể dư H2SO4
- Nếu T > 2 thì chỉ có phản ứng (1) và có thể dư NaOH.
- Nếu 1 thì có cả 2 phản ứng (1) và (2) ở trên.
Ngược lại:
Cho từ từ dung dịch NaOH vào dung dịch H2SO4 thì có các phản ứng xảy ra:
Phản ứng ưu tiên tạo ra muối axit trước.
H2SO4+ NaOH→ NaHSO4+ H2O (1)
Và sau đó
NaOHdu+ NaHSO4→ Na2SO4+H2O
Ví dụ: Một dung dịch A chứa HCl và H2SO4 theo tỉ lệ số mol 3:1, biết 100ml dung dịch A được trung hoà bởi 50ml dung dịch NaOH có chứa 20g NaOH/lit.
- Tính nồng độ mol của mỗi axit trong A.
- 200ml dung dịch A phản ứng vừa đủ với bao nhiêu ml dung dịch bazơ B chứa NaOH 0,2M và Ba(OH)2 0,1M.
- Tính tổng khối lượng muối thu được sau phản ứng giữa 2 dung dịch A và B.
Cách giải
Theo bài ra ta có:
nHCl/ nH2SO4=1/ 3
Đặt x là số mol của H2SO4, thì 3x là số mol của HCl
Số mol NaOH có trong 1 lít dung dịch là:
nNaOH=20/ 40=0,5
Nồng độ mol/lit của dung dịch NaOH là:
CM(NaOH)=0,5/ 1=0,5M
Số mol NaOH đã dung trong phản ứng trung hoà là:
nNaOH=0,05.0,5=0,025mol
PTHH xảy ra :
Tìm hiểu thêm: Các dạng bài tập este trong đề thi đại học và phương pháp giải
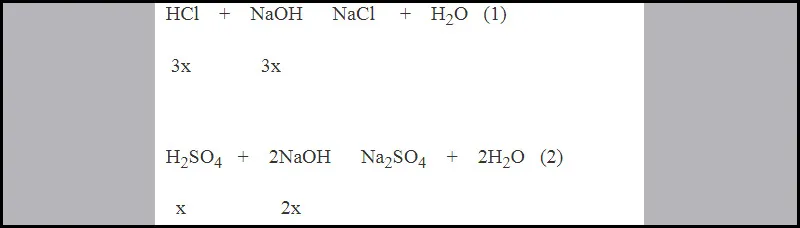
>>>>>Xem thêm: Liên kết cộng hóa trị là gì? Tổng hợp lý thuyết, bài tập liên quan
phương trình hóa học của phản ứng trung hòa
Từ PTHH (1) và (2) ta có :
3x + 2x = 0,025
⇔ 5x = 0,025
⇔ x = 0,005
Vậy:
nH2SO4=x= 0,005 mol
nHCl= 3x= 3.0,005=0,015 mol
Nồng độ của các chất có dung dịch A là:
CM(H2SO4)= 0,005/ 0,1= 0,05 M
CM(HCl)= 0,015/ 0,1= 0,15 M
Đặt HA là axit đại diện cho 2 axit đã cho. Trong 200 ml dung dịch A có:
nHA= nHCl+ 2nH2SO4= 0,015.0,2+ 0,05.0,2.2=0,05mol
Đặt MOH là bazơ đại diện và V (lít) là thể tích của dung dịch B chứa 2 bazơ đã cho:
nMOH= nNaOH+ 2nBa(OH)2= 0,2V+ 2.0,1V= 0,4V
Phương trình phản ứng trung hoà:
HA+ MOH→ MA+ H2O (3)
Theo phương trình phản ứng ta có:
nMOH= nHA= 0,05mol
Vậy:
0,4V = 0,05 V = 0,125 lít = 125 ml
Theo kết quả của câu b ta có:
nNaOH=0,125.0,2=0,025mol
nBa(OH)2=0,125.0,1=0,0125mol
nHCl=0,2.0,015=0,03mol
nH2SO4=0,2.0,05=0,01mol
Vì phản ứng trên là phản ứng trung hoà nên các chất tham gia phản ứng đều tác dụng hết nên dù phản ứng nào xảy ra trước thì khối lượng muối thu được sau cùng vẫn không thay đổi hay nó được bảo toàn.
mm= mSO4+ mNa+ mBa+ mCl
= 0,01.96 + 0,025.23 + 0,0125.137 + 0,03.35,5
= 0,96 + 1,065 + 0,575 + 1,7125 = 4,3125 gam
Gockhampha.edu.vn.Com.Vn đã tổng hợp những kiến thức hữu ích về chủ đề phản ứng trung hòa trong bài viết trên đây. Hy vọng bạn đã tìm thấy cho mình những thông tin cần thiết về chủ đề phản ứng trung hòa. Chúc bạn luôn học tốt!.
Xem chi tiết qua video của thầy Phạm Ngọc Sơn: