Phương pháp tăng giảm khối lượng là cách giải nhanh các dạng bài tập hóa học. Đặc biệt, phương pháp tăng giảm khối lượng được sử dụng rất nhiều trong chương trình hóa của các em học sinh lớp 9, lớp 10. Trong nội dung bài viết dưới đây, hãy cùng Gockhampha.edu.vn.COM.VN tìm hiểu chi tiết về chuyên đề này nhé!.
Bạn đang đọc: Phương pháp tăng giảm khối lượng: Nội dung và Các dạng bài tập
Contents
Phương pháp tăng giảm khối lượng là gì?
Nguyên tắc của phương pháp tăng giảm khối lượng: Phương pháp này được sử dụng khi dựa vào sự chênh lệch khối lượng khi biến đổi chất này thành chất khác có thể tính nhanh số mol của một chất trong phản ứng.
Các phương pháp tăng giảm khối lượng hóa 10
Phương pháp đại số
- Đặt ẩn cho số mol chất phản ứng.
- Lập phương trình biểu diễn độ tăng (hoặc giảm).
- Giải tìm ẩn và kết luận.
Phương pháp suy luận tăng giảm
- Dựa vào sự tăng giảm khối lượng khi chuyển 1 mol chất X thành 1 hay nhiều mol chất Y ta dễ dàng tính được số mol của các chất và ngược lại, từ số mol hoặc quan hệ về số mol của 1 hay các chất mà ta biết được sự tăng hay giảm khối lượng của các chất X,Y
Mấu chốt của phương pháp:
- Xác định đúng mối liên hệ tỉ lệ giữa các chất đã biết với chất cần xác định.
- Xem xét khi chuyển từ chất X thành chất Y thì khối lượng tăng lên hay giảm đi theo tỷ lệ phản ứng và theo đề cho.
- Sau cùng, dựa vào quy tắc tam suất, lập phương trình hóa học để giải.
Bài tập phương pháp tăng giảm khối lượng hóa 9
Dạng 1: Kim loại + axit HCl, H2SO4 loãng hoặc hợp chất có nhóm OH linh động
Ta có:
- 2M+2nHX→ 2MXn+nH2 (1)
- 2M+nH2SO4→ M2(SO4)n+nH2 (2)
- 2R(OH)n+2nNa→ 2R(ONa)n+nH2 (3)
Từ (1) và (2) ta thấy: khối lượng kim loại giảm vì đã tan vào dung dịch dưới dạng ion, nhưng nếu cô cạn dung dịch sau phản ứng thì khối lượng chất rắn thu được sẽ tăng lên so với khối lượng kim loại ban đầu, nguyên nhân là do có anion gốc axit thêm vào.
Từ (3) ta thấy: khi chuyển 1 mol Na vào trong muối sẽ giải phóng 0,5 mol hiđro tương ứng với sự tăng khối lượng là Dm=MRO. Do đó, khi biết số mol hiđro và Dm ta sẽ suy ra được R
Ví dụ 1: Cho m gam ancol đơn chất X vào bình đựng Na dư, sau phản ứng có 0,1 mol hiđro và khối lượng bình tăng 6,2 gam. Xác định CTPT của X.
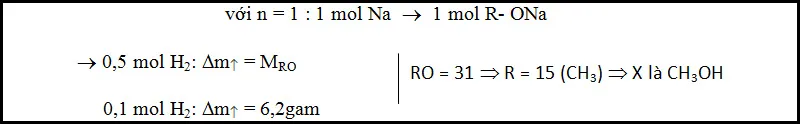
Dạng 2: Kim loại + Muối
KL + muối muối mới + KL mới
- Độ giảm: = khối lượng muối mới – khối lượng muối
- Độ tăng: = khối lượng muối – khối lượng muối mới
Ví dụ 2: Nhúng một thanh sắt nặng 8 gam vào 500 ml dung dịch CuSO4 2M. Sau một thời gian lấy lá sắt ra cân lại thấy nặng 8,8 gam. Xem thể tích dung dịch không thay đổi thì nồng độ mol/lit của CuSO4 trong dung dịch sau phản ứng là bao nhiêu?
Cách giải:
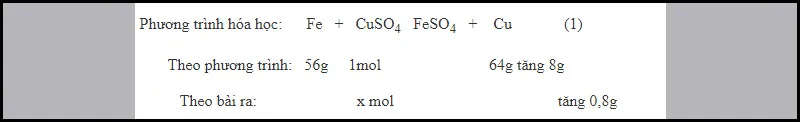
Số mol CuSO4 ban đầu là: 0,5.2 = 1 (mol)
Theo bài ra, ta thấy khối lượng thanh sắt tăng là: 8,8 – 8 = 0,8 (g).
Thế vào phương trình (1),từ đó suy ra: x = 0,1 (mol)
Do đó số mol CuSO4 còn lại sau phản ứng là 1 – 0,1 = 0,9 (mol)
Vậy CM CuSO4=0,9/0,5= 1,8M
Dạng 3: Muối này chuyển hóa thành muối khác
Khối lượng muối thu được có thể tăng hoặc giảm do có sự thay thế anion gốc axit này bằng gốc anion gốc axit khác, sự thay thế luôn tuân theo quy tắc hóa trị (nếu hóa trị của nguyên tố kim loại không thay đổi)
- MxOy→ MxCl2y (cứ 1 mol O−2 được thay thế bằng 2 mol Cl−)
- MxOy→ Mx(SO4)y (cứ 1 mol O−2 được thay thế bằng 1 mol SO2−4)
Dạng 4: Muối + Muối
Ví dụ 3: Cho dung dịch AgNO3 dư tác dụng với dung dịch hỗn hợp có hòa tan 6,25 gam hai muối KCl và KBr thu được 10,39 gam hỗn hợp AgCl và AgBr. Hãy xác định số mol hỗn hợp đầu.
Cách giải:
Đặt công thức chung của Cl và Br là M (I), khi đó ta có phương trình:
AgNO3+KM→ KNO3+AgM

Từ phương trình (2), suy ra: x = 0,06 mol
Vậy tổng số mol hỗn hợp đầu là:
n KM=0,06 (mol)
Dạng 5: Muối cacbonat (muối sunfit) + HCl
Ví dụ 4: Cho 3,06 gam hỗn hợp hai muối K2CO3 và MgCO3 tác dụng với dung dịch HCl thu được V lít khí (đktc) và dung dịch X. Cô cạn dung dịch X được 3,39 gam muối khan. Tính giá trị của V?
Cách giải:
Ta có:
Tìm hiểu thêm: Axit succinic là gì? Tính chất, ứng dụng và cách điều chế
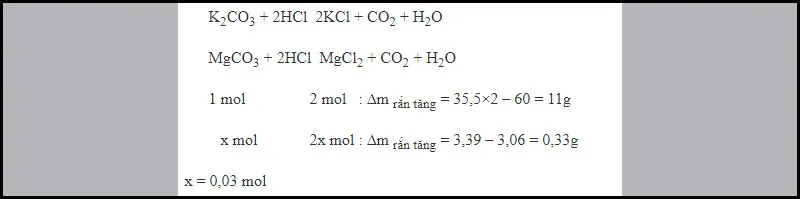
Vậy V= 0,03.22,4= 0,672 l
Dạng 6: Bài toán nhiệt luyện
Oxit(X)+CO(H2)→ (Yr)+CO2(H2)

Dạng 7: Bài toán nhiệt phân
Ví dụ 5: Nung 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khi khối lượng hỗn hợp không đổi thu được 69 gam chất rắn. Tính số mol Na2CO3 sau phản ứng.
Cách giải:
Chỉ có muối NaHCO3 bị nhiệt phân:
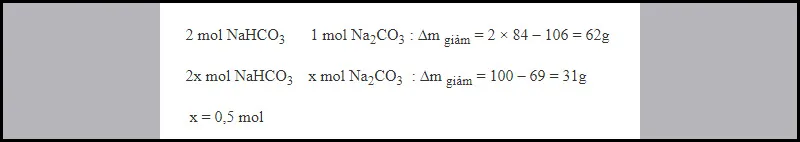
>>>>>Xem thêm: Chuyên đề: Lý thuyết về Nhôm và Hợp chất của Nhôm
Đánh giá về phương pháp tăng giảm khối lượng
- Phương pháp này cho phép ta giải nhanh được nhiều bài toán khi đã biết quan hệ về khối lượng cũng như tỉ lệ của mỗi chất trước và sau phản ứng.
- Trong trường hợp, chưa biết phản ứng có xảy ra hoàn toàn hay không thì sử dụng phương pháp này sẽ giúp đơn giản hóa bài toán đã cho.
- Với mọi bài toán được giải bằng phương pháp tăng giảm khối lượng thì cũng được giải bằng phương pháp bảo toàn khối lượng.
- Phương pháp này cũng thường được dùng trong các bài tập hỗn hợp nhiều chất.
Gockhampha.edu.vn.Com.Vn đã giúp bạn tổng hợp kiến thức về các dạng bài tập tăng giảm khối lượng. Hy vọng rằng với những thông tin trên sẽ hữu ích cho bạn trong quá trình học tập cũng như tìm hiểu về chủ đề phương pháp tăng giảm khối lượng. Chúc bạn luôn học tốt!.

