Sự điện li là một kiến thức cơ bản của môn hóa học lớp 11, tuy nhiên đây lại là kiến thức quan trọng bạn cần phải nhớ để có thể phân biệt được sự điện li. Vì vậy, bài viết hôm nay chúng ta sẽ cùng tìm hiểu sự điện li là gì, tích chất, phân loại chất điện li và củng cố bằng những bài tập ví dụ.
Bạn đang đọc: Sự điện li là gì? Cách phân loại và Bài tập về chất điện li
Contents
Sự điện li là gì?
Định nghĩa
Quá trình phân li của các chất trong nước ra ion được gọi là sự điện li. Những chất khi tan trong nước ra ion còn gọi là chất điện li.
Các phân tử chất điện li khi tan trong nước sẽ cho ra các cation (ion dương) và anion (ion âm) được tách ra từ phân tử đó. Khả năng dẫn điện của các dung dịch này dựa vào các ion trên.
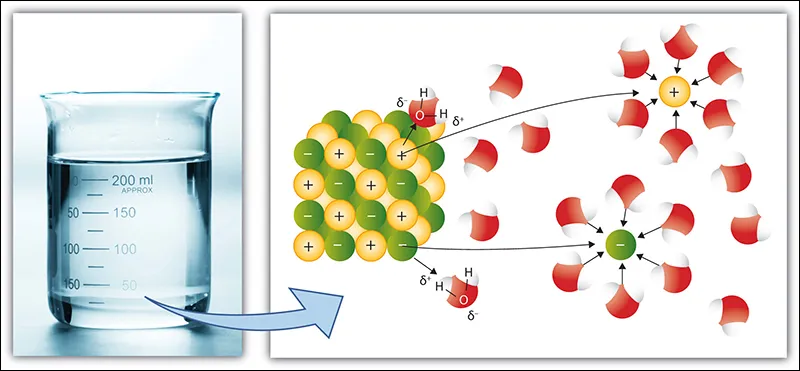
Tính chất của chất điện li
Các hợp chất hóa học như axit, bazo và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion. Vì ion có thể chuyển động tự do trong dung dịch nên iom có thể tải điện (hạt tải điện).
Sự phân li của một số hợp chất:
- Axit → gốc axit (ion âm) + H+
- Bazo → OH– (ion âm) + ion dương (kim loại).
- Muối → gốc axit (ion âm) + ion dương (kim loại).
- Một số bazo không chứa ion kim loại nhưng cũng bị phân li thành ion trong dung dịch.
Độ điện li là gì?
Độ điện li được dùng để biểu thị mức độ phân li ra ion của các chất điện li:
Với α là độ điện li của các chất được tính bằng tỉ số giữa phân tử phân li thành ion(n) và phân tử hòa tan n(0), gồm có:
- Chất không điện li hay còn gọi là không phân li: α = 0.
- Chất điện li yếu hay không phân li hoàn toàn: 0
- Chất điện li mạnh hay phân li hoàn toàn: α = 1.
Nói cách khác: Ở cùng một nhiệt độ và cùng nồng độ mol/lít độ điện li α càng lớn thì chất điện li đó càng mạnh.
Ngoài ra độ điện li cũng có thể tính dựa vào nồng độ mol (C). Ta có biểu thức:
α = n /n(0) = C /C(0)
Trong đó:
- n là số phân tử phân li ra ion.
- n(0) là số phân tử hòa tan.
- C là nồng độ mol chất tan phân li thành ion.
- C(0) là nồng độ mol chất hòa tan.
Độ điện li α phụ thuộc vào:
- Nhiệt độ.
- Bản chất của dung môi.
- Bản chất của chất tan.
- Nồng độ chất điện li.
Tìm hiểu thêm: Hóa học là gì? Vai trò của hóa học trong đời sống
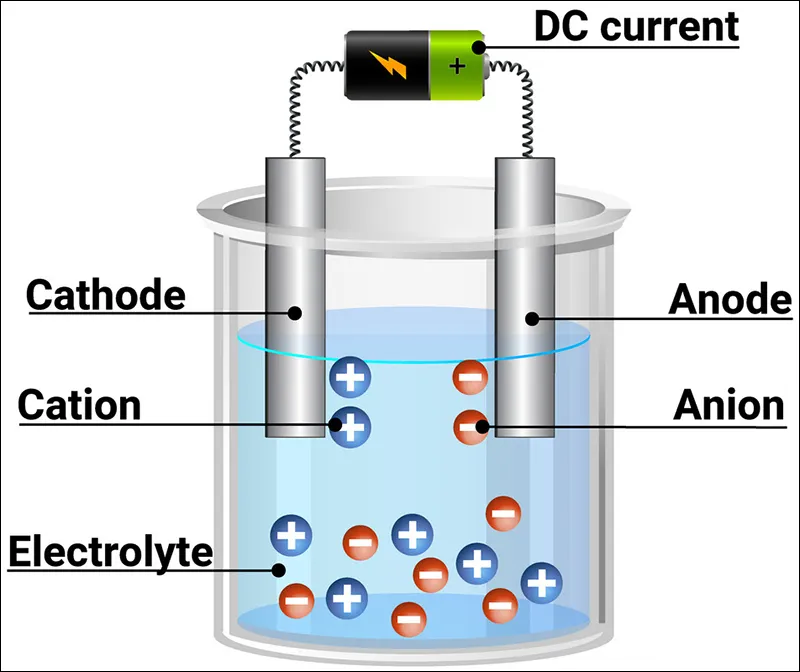
Phân loại chất điện li
Chất điện li mạnh
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
Ví dụ: Nếu trong dung dịch có 100 phân tử NaCl mà 100 phân tử ấy đều phân li ra ion thì NaCl là chất điện li mạnh.
Người ta sử dụng mũi tên một chiều để biểu diễn phương trình chất điện li mạnh.
NaCl → (Na+) + (Cl-)
Một số chất điện li mạnh:
- Axit: HCl, HNO3,H2SO4,…
- Bazo mạnh: NaOH, KOH, Ba(OH)2, Ca(OH)2,…
- Muối của axit mạnh hoặc bazo mạnh:NaCl, KNO3, KCl, K2SO4,…
Chất điện li yếu
Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ: Trong dung dịch CH3COOH 0,043M, cứ 100 phân tử hòa tan có 2 phân tử phân li ra ion, còn lại 98 phân từ không phân li. Vậy CH3COOH là chất điện li yếu.
Một số chất điện li yếu:
- Các axit yếu: CH3COOH, HClO, H2S, HE, HCN, H2SO4,…
- Các bazơ yếu: Bi(OH)3, Mg(OH)2,…
Sự điện li của chất điện li yếu là một quá trình thuận nghịch. Cân bằng điện li được thiết lập khi tốc độ phân li ra ion bằng với tốc độ kết hợp các ion thành phân tử. Đây là cân bằng động. Giống như mọi cân bằng hóa học khác, chúng tuân theo nguyên lí chuyển dịch cân bằng LG Sa-tơ-li-ê. Vì vậy trong phương trình điện li yếu người ta sử dụng hai mũi tên ngược chiều nhau.
CH3COOH ⇌ (CH3COO-) + (H+)
Bài tập về sự điện li SGK Hóa học 11 kèm lời giải chi tiết
Giải bài 1 trang 7 SGK Hóa 11
Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện được là do nguyên nhân gì?
Giải
Trong dung dịch: Các axit, bazơ và muối phân li ra các ion dương và ion âm chuyển động tự do nên dung dịch của chúng có khả năng dẫn điện.
HCl → (H+) + (Cl-)
NaOH → (Na+) + (OH-)
NaCl → (Na+) + (Cl-)
Còn các dung dịch như ancol etylic, đường saccarozơ, glixerol không dẫn điện vì trong dung dịch chúng không phân li ra các ion dương và ion âm.
Giải bài 2 SGK Hóa 11 trang 7
Sự điện li, chất điện li là gì? Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy thí dụ và viết phương trình điện li của chúng?
Giải
Sự điện li là quá trình phân li của các chất trong nước ra ion.
Chất điện li là những chất khi tan trong nước ra ion và dẫn được điện.
Các chất là chất điện li như axit, các bazơ, các muối tan được trong nước.
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
Ví dụ:
H2SO4 → 2(H+) + ((SO4)2-)
KOH → (K+) + (Cl-)
Na2SO4 → 2(Na+) + ((SO4)2-)
Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ: H2S ⇌ (H+) + (HS-)
Giải bài 3 SGK trang 7 Hóa 11
Viết phương trình điện li của những chất sau:
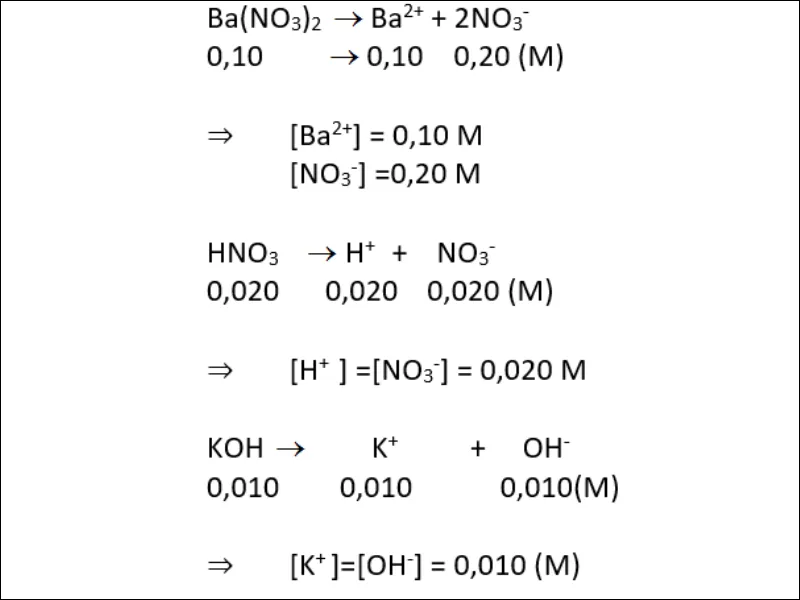
a) Các chất điện li mạnh: Ba(NO3)2 0.10 M; HNO3 0,020 M; KOH 0,010 M. Tính nồng độ mol của từng ion trong dung dịch.
b) Các chất điện li yếu HClO; HNO2.
Giải
a) Các chất điện li mạnh
>>>>>Xem thêm: Phương pháp trung bình trong hóa học: Cơ sở lý thuyết và Các dạng bài tập
b) Các chất điện li yếu
HClO ⇔ (H+) + (ClO-)
HNO2 ⇔ (H+) + (NO2-)
Bài viết trên đây của Gockhampha.edu.vn.COM.VN đã cung cấp những thông tin về khái niệm sự điện li là gì, thế nào là chất điện li mạnh, chất điện li yếu cũng như các dạng bài tập về sự điện li. Hy vọng những kiến thức trên đây sẽ hữu ích với bạn!

