Chuyên đề nhận biết các chất hóa học là dạng bài tập quen thuộc thường gặp trong chương trình Hóa lớp 9, lớp 11 hay 12. Để giải các dạng bài tập nhận biết các chất hóa học, yêu cầu học sinh cần nắm chắc kiến thức cũng như các phương pháp giải. Bài viết dưới đây của Gockhampha.edu.vn.COM.VN sẽ giúp bạn tổng hợp các kiến thức về chủ đề nhận biết các chất hóa học, cùng tìm hiểu nhé!.
Bạn đang đọc: Chuyên đề phương pháp nhận biết các chất hóa học
Contents
Chuyên đề nhận biết các chất hóa học lớp 9
Nguyên tắc và yêu cầu khi giải bài tập nhận biết
Để phân biệt hay nhận biết các chất hóa học, ta cần dựa vào phản ứng đặc trưng và xem xét các hiện tượng: Như có chất kết tủa tạo thành sau phản ứng, việc đổi màu dung dịch, giải phóng chất có mùi hoặc có hiện tượng sủi bọt khí. Hoặc để nhận biết các chất hóa học, bạn có thể sử dụng một số tính chất vật lí (nếu như bài cho phép) như nung ở nhiệt độ khác nhau, hay hoà tan các chất vào nước…
Phản ứng hoá học được chọn để nhận biết là phản ứng đặc trưng đơn giản và có dấu hiệu rõ rệt. Trừ trường hợp đặc biệt, thông thường muốn nhận biết n hoá chất cần phải tiến hành (n – 1) thí nghiệm.
Tất cả các chất được lựa chọn dùng để nhận biết các hoá chất theo yêu cầu của đề bài, đều được coi là thuốc thử.
Lưu ý: Khái niệm phân biệt bao hàm ý so sánh (ít nhất phải có hai hoá chất trở lên) nhưng mục đích cuối cùng của phân biệt cũng là nhằm nhận biết tên của một số hoá chất nào đó.
Phương pháp giải bài tập nhận biết các chất hóa học
Bước 1: Đầu tiên cần chiết (trích mẫu thử) các chất cần nhận biết vào các ống nghiệm (có đánh số cụ thể).
Bước 2: Chọn thuốc thử thích hợp (tuỳ theo yêu cầu đề bài: thuốc thử tuỳ chọn, hạn chế hay không dùng thuốc thử nào khác).
Bước 3:Cho vào các ống nghiệm ghi nhận các hiện tượng, sau đó rút ra kết luận đã nhận biết, phân biệt được hoá chất nào.
Bước 4: Viết PTHH minh hoạ.
Các dạng bài tập thường gặp
Dạng 1: Nhận biết hoặc phân biệt các hoá chất (rắn, lỏng, khí) riêng biệt.
Dạng 2: Nhận biết hoặc phân biệt các chất trong cùng một hỗn hợp.
Dạng 3: Xác định việc có mặt của các chất (hoặc các ion) trong cùng một dung dịch.
Tuỳ theo yêu cầu của bài tập mà trong mỗi dạng có thể gặp 1 trong các trường hợp sau:
- Nhận biết với thuốc thử tự do (tùy chọn).
- Nhận biết với thuốc thử hạn chế (có giới hạn).
- Nhận biết không được dùng thuốc thử bên ngoài.
Phương pháp nhận biết các chất vô cơ
Đối với chất khí
- Khí CO2: Sử dụng dung dịch nước vôi trong có dư, hiện tượng xảy ra là làm đục nước vôi trong.
- Khí SO2: Có mùi hắc khó ngửi, làm phai màu hoa hồng hoặc Làm mất màu dung dịch nước Brôm hoặc làm mất màu dung dịch thuốc tím.
- 5SO2+2KMnO4+2H2O→2H2SO4+2MnSO4+K2SO4
- Khí NH3: Có mùi khai, làm cho quỳ tím tẩm ướt hóa xanh.
- Khí Clo: Sử dụng dung dịch KI + Hồ tinh bột để thử clo làm dung dịch từ màu trắng chuyển thành màu xanh.
- Cl2+KI→2KCl+I2
- Khí H2S: Có mùi trứng thối, dùng dung dịch Pb(NO3)2 để tạo thành PbS kết tủa màu đen.
- Khí HCl: Làm giấy quỳ tẩm ướt hoá đỏ hoặc sục vào dung dịch AgNO3 tạo thành kết tủa màu trắng của AgCl.
- Khí N2: Đưa que diêm đỏ vào làm que diêm tắt.
- Khí NO (không màu): Để ngoài không khí hoá màu nâu đỏ.
- Khí NO2 (màu nâu đỏ): Mùi hắc, làm quỳ tím tẩm ướt hoá đỏ.
- 4NO2+2H2O+O2→4HNO3
Nhận biết dung dịch bằng quỳ tím
- Để dùng quỳ tím nhận biết các chất, ta cần lưu ý như sau:
- Nhận biết dung dịch bazơ (kiềm): Làm quỳ tím hoá xanh
- Nhận biết dung dịch axit: Làm quỳ tím hoá đỏ
Nhận biết dung dịch bazơ
- Nhận biết Ca(OH)2:
- Dùng CO2 sục vào đến khi xuất hiện kết tủa thì dừng lại.
- Dùng Na2CO3 để tạo thành kết tủa màu trắng của CaCO3
- Nhận biết Ba(OH)2:
- Dùng dung dịch H2SO4 để tạo thành kết tủa màu trắng của Ba2SO4
Nhận biết dung dịch axit
- Dung dịch HCl: Dùng dung dịch AgNO3 làm xuất hiện kết tủa màu trắng của AgCl.
- Dung dịch H2SO4: Dùng dung dịch BaCl2 hoặc Ba(OH)2 tạo ra kết tủa BaSO4.
- Dung dịch HNO3: Dùng bột đồng đỏ và đun ở nhiệt độ cao làm xuất hiện dung dịch màu xanh và có khí màu nâu thoát ra của NO2.
- Dung dịch H2S: Dùng dung dịch Pb(NO3)2 xuất hiện kết tủa màu đen của PbS.
- Dung dịch H3PO4: Dùng dung dịch AgNO3 làm xuất hiện kết tủa màu vàng của Ag3PO4.
Nhận biết các dung dịch muối
- Muối clorua: Sử dụng dung dịch AgNO3.
- Muối sunfat: Sử dụng dung dịch BaCl2 hoặc Ba(OH)2.
- Muối cacbonat: Sử dụng dung dịch HCl hoặc H2SO4.
- Muối sunfua: Sử dụng dung dịch Pb(NO3)2.
- Muối phôtphat: Sử dụng dung dịch AgNO3 hoặc dùng dung dịch CaCl2, Ca(OH)2 làm xuất hiện kết tủa mùa trắng của Ca3(PO4)2.
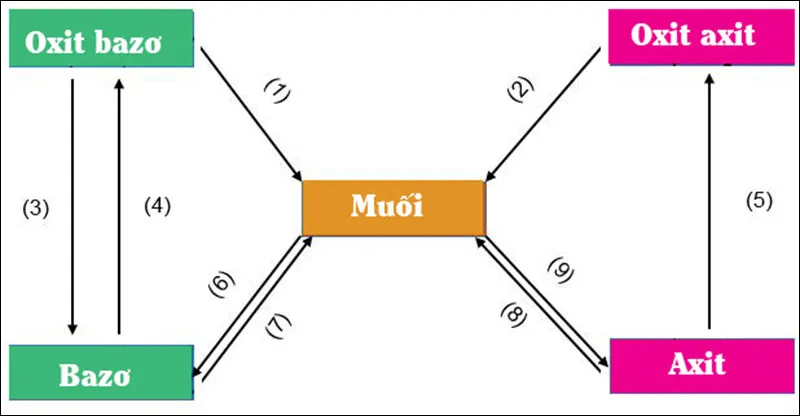
Nhận biết các oxit của kim loại
- Hỗn hợp oxit: Hoà tan từng oxit vào nước (Bao gồm 2 nhóm: Tan trong nước và không tan trong nước).
- Nhóm tan trong nước cho tác dụng với CO2
- Nếu không có kết tủa: Kim loại trong oxit là kim loại kiềm.
- Nếu xuất hiện kết tủa: Kim loại trong oxit là kim loại kiềm thổ.
- Nhóm không tan trong nước cho tác dụng với dung dịch bazơ.
- Nếu oxit tan trong dung dịch kiềm thì kim loại trong oxit là Be, Al, Zn, Cr..
- Nếu oxit không tan trong dung dịch kiềm thì kim loại trong oxit là kim loại kiềm thổ.
Nhận biết một số oxit
- (Na2O;K2O;BaO) cho tác dụng với nước → dd trong suốt, làm xanh quỳ tím.
- (ZnO;Al2O3) vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch bazơ.
- CuO tan trong dung dịch axit tạo thành dung dịch có màu xanh đặc trưng.
- P2O5 cho tác dụng với nước→ dung dịch làm quỳ tím hoá đỏ.
- MnO2 cho tác dụng với dung dịch HCl đặc có khí màu vàng xuất hiện.
- SiO2 không tan trong nước, nhưng tan trong dd NaOH (Natri hiđroxit) hoặc dung dịch HF.
Nhận biết các chất kết tủa
Màu của một số kết tủa thường gặp
- Al(OH)3: kết tủa keo trắng.
- FeS: kết tủa màu đen.
- Fe(OH)2: kết tủa trắng xanh.
- Fe(OH)3: kết tủa nâu đỏ.
- FeCl2: dung dịch lục nhạt.
- FeCl3: dung dịch vàng nâu.
- Cu: kết tủa là màu đỏ.
- Cu(NO3)2: dung dịch xanh lam.
- CuCl2: tinh thể có màu nâu, dung dịch xanh lá cây.
- Fe3O4 (rắn): màu nâu đen.
- CuSO4: tinh thể khan màu trắng, tinh thể ngậm nước màu xanh lam, dung dịch xanh lam.
- Cu2O: đỏ gạch.
- Cu(OH)2: kết tủa xanh lơ (xanh da trời).
- CuO: kết tủa màu đen.
- Zn(OH)2: kết tủa keo trắng.
- Ag3PO4: kết tủa vàng.
- AgCl: kết tủa màu trắng.
- AgBr: kết tủa vàng nhạt.
- AgI: kết tủa vàng cam (hay vàng đậm).
- Ag2SO4: kết tủa trắng.
- MgCO3: kết tủa trắng.
- CuS,FeS,Ag2S,PbS,HgS: màu đen.
- BaSO4: kết tủa trắng.
- BaCO3: kết tủa trắng.
- CaSO3: kết tủa trắng.
- Mg(OH)2: kết tủa màu trắng.
- PbI2: kết tủa vàng tươi.
Phương pháp nhận biết các chất hóa học hữu cơ lớp 11
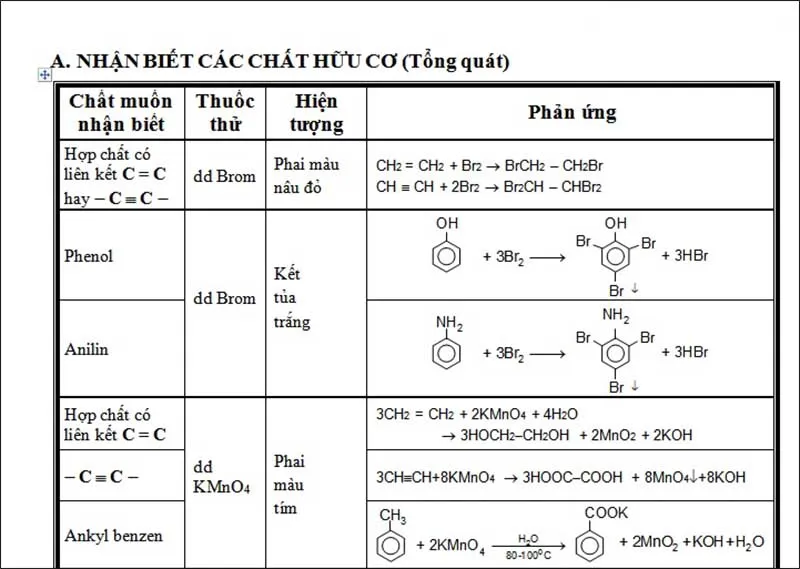
Với đề thi THPT Quốc gia môn Hóa, dạng bài tập nhận biết các chất là dạng bài thường gặp và dễ lấy điểm. Mỗi loại chất sẽ có những thuốc thử thường dùng khác nhau để phân biệt. Dưới đây là bảng nhận biết các chất hữu cơ tổng kết các thuốc thử thường dùng cũng như hiện tượng thu được khi nhận biết các hợp chất hữu cơ thường gặp.
Bảng nhận biết các chất hữu cơ tổng quát
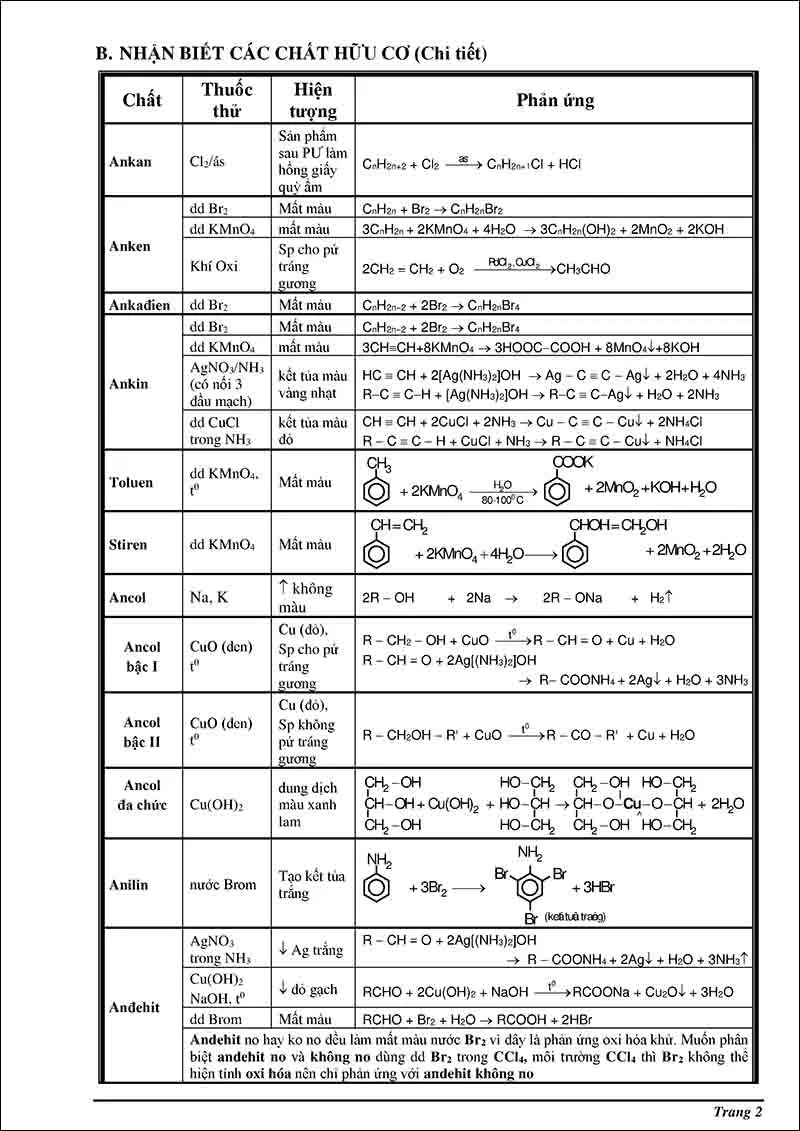
Bảng nhận biết các chất hữu cơ chi tiết
Tìm hiểu thêm: Chuyên đề Phương pháp đồ thị trong hóa học và Các dạng bài tập
Bảng nhận biết các chất hóa học lớp 8
Bảng nhận biết một số cation thường gặp
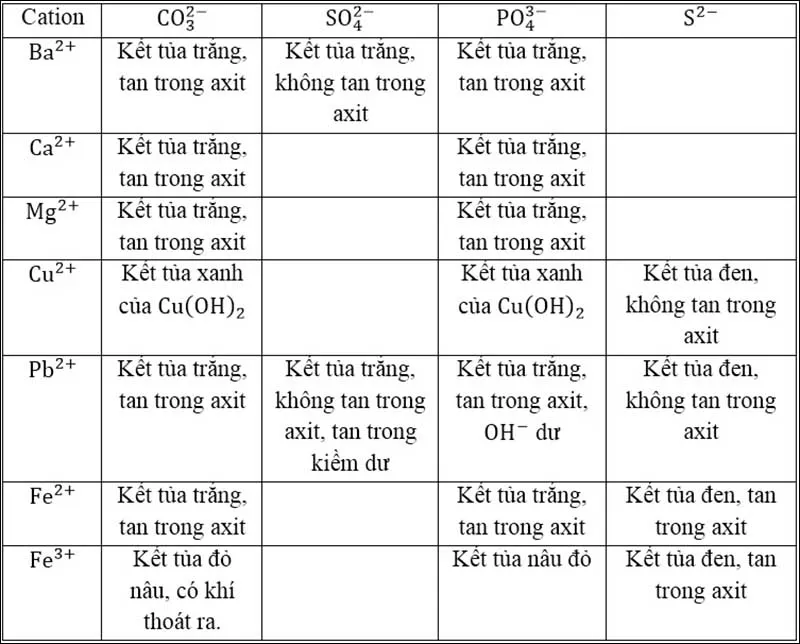
Bảng nhận biết một số anion hay gặp
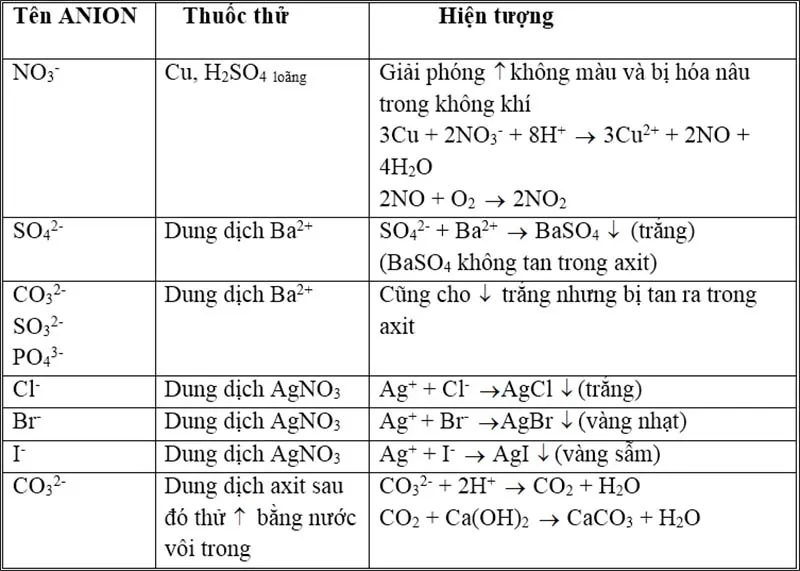
>>>>>Xem thêm: Tính chất hóa học của axit là gì? Cách phân loại axit và Các loại axit tiêu biểu
Như vậy, Gockhampha.edu.vn.VN đã giúp bạn tổng hợp những kiến thức hữu ích về chủ đề phương pháp nhận biết các chất hóa học. Chúc bạn luôn học tốt!.

