Tính chất hóa học của muối là gì? Lý thuyết và các dạng bài tập về tính chất hóa học của muối? Thế nào là tính chất hóa học của muối axit?… Trong phạm vi bài viết dưới đây, Gockhampha.edu.vn.COM.VN sẽ giới thiệu đến các bạn chủ đề về bài 9 tính chất hóa học của muối, cùng tìm hiểu nhé!
Bạn đang đọc: Tính chất hóa học của muối: Lý thuyết và Các dạng bài tập
Contents
Tính chất hóa học của muối là gì?
Tác dụng với kim loại
Trong hóa học, dung dịch của muối tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
- Fe+CuSO4→FeSO4+Cu
- Cu+2AgNO3→Cu(NO3)2+2Ag
Tác dụng với axit
Muối sẽ tác dụng được với axit tạo thành muối mới và axit mới.
Ví dụ:
- BaCl2+H2SO4→2HCl+BaSO4
- CaCO3+2HCl→CaCl2+CO2+H2O
Tác dụng với dung dịch muối
Khi hai dung dịch muối tác dụng với nhau sẽ tạo thành hai muối mới.
Ví dụ:
- AgNO3+NaCl→NaNO3+AgCl
Tác dụng với dung dịch bazơ
Khi dung dịch bazơ tác dụng với dung dịch bazơ sẽ tạo thành muối mới và bazơ mới.
Ví dụ:
- Na2CO3+Ba(OH)2→2NaOH+BaCO3
Phản ứng phân hủy muối
Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3,KMnO4,CaCO3,…
Ví dụ:
- 2KClO3→t∘2KCl+3O2
- CaCO3→t∘CaO+CO2
Tìm hiểu phản ứng trao đổi trong dung dịch
Định nghĩa phản ứng trao đổi là gì?
Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
Điều kiện xảy ra phản ứng trao đổi
Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí.
Ví dụ:
- CuSO4+2NaOH→Na2SO4+Cu(OH)2
- K2SO4+NaOH: Phản ứng không xảy ra.
Chú ý: phản ứng trung hòa cũng thuộc loại phản ứng trao đổi và luôn xảy ra.
Ví dụ:
- H2SO4+2NaOH→Na2SO4+2H2O
Các dạng bài tập về tính chất hóa học của muối
Bài 1: Có những dung dịch muối sau: Mg(NO3)2,CuCl2. Hãy cho biết muối nào có thể tác dụng với:
- Dung dịch NaOH.
- Dung dịch HCl.
- Dung dịch Ag(NO)3.
Nếu có phản ứng, hãy viết các phương trình hóa học.
Cách giải:
Tác dụng với dung dịch NaOH là dung dịch các muối Mg(NO3)2,CuCl2 vì sinh ra:
- Mg(OH)2 kết tủa, Cu(OH)2 kết tủa.
- Mg(NO3)2+2NaOH→Mg(OH)2+2NaNO3
- CuCl2+2NaOH→Cu(OH)2+2NaCl
Không muối nào tác dụng với dung dịch HCl.
Tác dụng với dung dịch AgNO3 là dung dịch muối CuCl2 tạo AgCl kết tủa trắng.
- CuCl2+2AgNO3→2AgCl+Cu(NO3)2
Bài 2: Trộn 30ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa 1,7 g AgNO3.
a) Hãy cho biết hiện tượng quan sát được và viết phương trình hóa học.
b) Tính khối lượng chất rắn sinh ra.
c) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích của dung dịch thay đổi không đáng kể.
Cách giải:
Tìm hiểu thêm: Điều chế khí oxi là gì? Phản ứng phân hủy là gì? – Hóa học 8 Bài 27

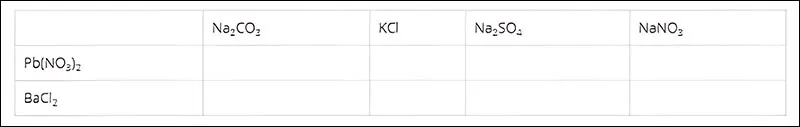
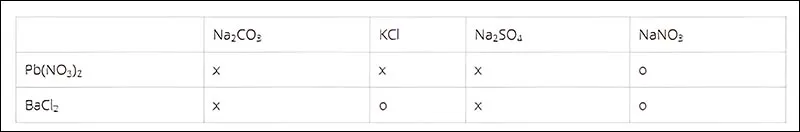
Bài 3: Cho những dung dịch muối sau đây phản ứng với nhau từng đôi một, hãy ghi dấu (x) nếu có phản ứng, dấu (0) nếu không:
Hãy viết phương trình hóa học ở ô có dấu (x).
Cách giải:
>>>>>Xem thêm: CFC là gì? Đặc điểm, ứng dụng và tác hại của khí CFC
Phương trình hóa học của các phản ứng:
- Pb(NO3)2+Na2CO3→PbCO3+2NaNO3
- Pb(NO3)2+2KCl→PbCl2+2KNO3
- Pb(NO3)2+Na2SO4→PbSO4+2NaNO3
- BaCl2+Na2CO3→BaCO3+2NaCl
- BaCl2+Na2SO4→BaSO4+2NaCl.
Bài viết trên đây của Gockhampha.edu.vn.VN đã giúp bạn tổng hợp kiến thức về chủ đề tính chất hóa học của muối axit, hy vọng đã cung cấp cho bạn những kiến thức hữu ích phục vụ cho quá trình học tập. Chúc bạn luôn học tốt!